Page 52 - Traité de Chimie Thérapeutique 2 : Médicaments Antibiotiques
P. 52
42 MÉDICAMENTS ANTIBIOTIQUES
H H
s
C H 0CH COHN "- j_ ~l:
I
•
1) Séparation du 9 5 2
dlutérêolaomére
i- ,,
2) NH,· NH, C NH
t:\ , "
3) C,H,0-CH,CO-CI V HO O -~
H COOH
4) HCI
acide phènoxyacétyl pénlclllolque
H H
5
C9H50CH2Nl+CC>-NH r-71
.
_
/
·
_/
1) NaOH
,.,, ..,,
c-N
0 // .,,, COOH
dlcyclohexylcarbodilmide ( DCC) pénicilline V H
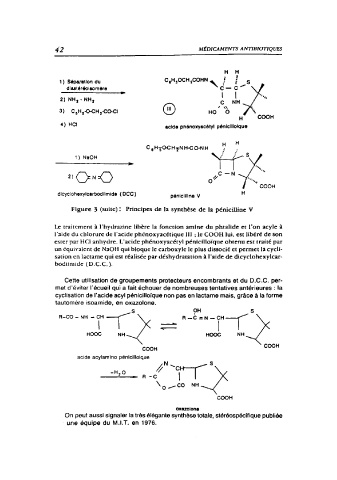
Figure 3 (suite): Principes de la synthèse de la pénicilline V
Le traitement à l"hydrazine libère la fonction amine du phtalide et l'on acyle à
l'aide du chlorure de l'acide phénoxyacétique III ; le COOH lui, est libéré de son
ester par HCI anhydre. L'acide phénoxyacétyl pénicilloïque obtenu est traité par
un équivalent de NaOH qui bloque le carboxyle le plus dissocié et permet la cycli-
sation en lactame qui est réalisée par déshydratation à l'aide de dicyclohexylcar-
bodiimide ( D.C.C. ).
Cette utilisation de groupements protecteurs encombrants et du D.C.C. per-
met d'éviter l'écueil qui a fait échouer de nombreuses tentatives antérieures: la
cyclisation de l'acide acyl pénicilloïque non pas en lactame mais, grâce à la forme
tautomère isoamide, en oxazolone. 5
---n' ·"·1y
----
HOOC NH--< ~ NH
HOOC COOH
COOH
acide acylamino pénicilloicque
oxazolone
On peut aussi signaler la très élégante synthèse totale, stéréospécifique publiée
une équipe du M.I.T. en 1976.