Page 286 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 286
Chapitre 12 Les arènes
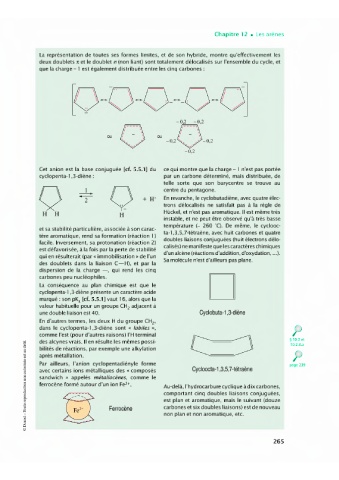
La représentation de toutes ses formes limites, et de son hybride, montre qu'effectivement les
deux doublets r et le doublet n (non liant) sont totalement délocalisés sur l'ensemble du cycle, et
que la charge - l est également distribuée entre les cinq carbones :
-0,2 -0,2
ou
-0,2
Cet anion est la base conjuguée [cf. 5.5.1] du ce qui montre que la charge - l n'est pas portée
par un carbone déterminé, mais distribuée, de
cyclopenta-1 ,3-diène: telle sorte que son barycentre se trouve au
-
1
Q ..-- Q centre du pentagone.
En revanche, le cyclobutadiène, avec quatre élec-
2
trons délocalisés ne satisfait pas à la règle de
H H H Hückel, et n'est pas aromatique. Il est même très
instable, et ne peut être observé qu'à très basse
température (- 260 C). De même, le cyclooc-
et sa stabilité particulière, associée à son carac-
ta- l ,3,5,7-tétraène, avec huit carbones et quatre
tère aromatique, rend sa formation (réaction l)
doubles liaisons conjuguées (huit électrons délo-
facile. Inversement, sa protonation (réaction 2)
calisés) ne manifeste que les caractères chimiques
est défavorisée, à la fois par la perte de stabilité
d'un alcène (réactions d'addition, d'oxydation, ...).
qui en résulterait (par « immobilisation » de l'un
Sa molécule n'est d'ailleurs pas plane.
des doublets dans la liaison CH), et par la
dispersion de la charge -, qui rend les cinq
carbones peu nucléophiles.
La conséquence au plan chimique est que le
cyclopenta-1 ,3-diène présente un caractère acide □
marqué : son pK, [cf. 5.5.1] vaut l6, alors que la
valeur habituelle pour un groupe CH-, adjacent à
une double liaison est 40. Cyclobuta-1,3-diène
En d'autres termes, les deux H du groupe CH,,
dans le cyclopenta-l,3-diène sont « labiles », p
comme l'est (pour d'autres raisons) l'H terminal
§ 10.2 et
des alcynes vrais. Il en résulte les mêmes possi-
10.2.3.a
bilités de réactions, par exemple une alkylation
2
après métallation.
Par ailleurs, l'anion cyclopentadiényle forme page 239
avec certains ions métalliques des « composés Cycloocta-1,3,5,7-tétraène
sandwich » appelés métallocènes, comme le
ferrocène formé autour d'un ion Fe?+, Au-delà, l'hydrocarbure cyclique à dix carbones,
comportant cinq doubles liaisons conjuguées,
est plan et aromatique, mais le suivant (douze
Ferrocène carbones et six doubles liaisons) est de nouveau
non plan et non aromatique, etc.
265