Page 360 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 360
4. LES NORMOUPÉMIANTS 321
R3
H 23
COOH 12
4
N-----N
CH2OH 15
CO-CH3 13
ch2och3 11
ch2-nh2 4
CH2N (CH^ 10
COOH 6
26
N----- N
CH2OH 350
CO-CH3 500
CH2OCH3 >500
ch2-nh2 >500
H > 500
11
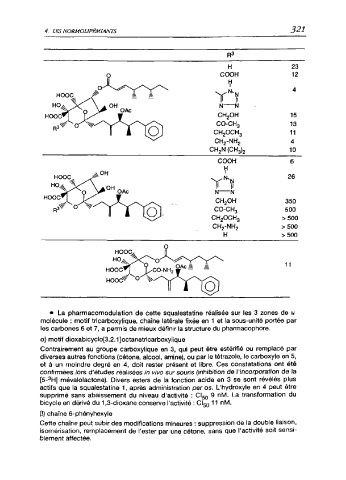
• La pharmacomodulation de cette squalestatine réalisée sur les 3 zones de U
molécule : motif tricarboxylique, chaîne latérale fixée en 1 et la sous-unité portée par
les carbones 6 et 7, a permis de mieux définir la structure du pharmacophore.
a) motif dioxabicyclo[3.2.1]octanetricarboxylique
Contrairement au groupe carboxylique en 3, qui peut être estérifié ou remplacé par
diverses autres fonctions (cétone, alcool, amine), ou par le tétrazole, le carboxyle en 5,
et à un moindre degré en 4, doit rester présent et libre. Ces constatations ont été
confirmées lors d'études réalisées in vivo sur souris (inhibition de l'incorporation de la
[5-3H] mévalolactone). Divers esters de la fonction acide en 3 se sont révélés plus
actifs que la squalestatine 1, après administration per os. L'hydroxyle en 4 peut être
supprimé sans abaissement du niveau d'activité : CI50 9 nM. La transformation du
bicycle en dérivé du 1,3-dioxane conserve l'activité : CI50 11 nM.
(3) chaîne 6-phényhexyle
Cette chaîne peut subir des modifications mineures : suppression de la double liaison,
isomérisation, remplacement de l'ester par une cétone, sans que l'activité soit sensi
blement affectée.