Page 432 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 432
6. GÉNÉRALITÉS SILR LES STÉROÏDES 393
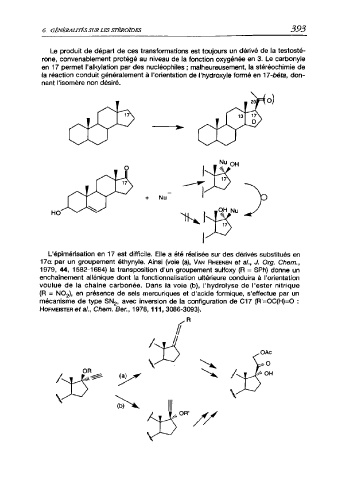
Le produit de départ de ces transformations est toujours un dérivé de la testosté
rone, convenablement protégé au niveau de la fonction oxygénée en 3. Le carbonyle
en 17 permet l'alkylation par des nucléophiles ; malheureusement, la stéréochimie de
la réaction conduit généralement à l'orientation de l'hydroxyle formé en 17-béta, don
nant l'isomère non désiré.
L'épimérisation en 17 est difficile. Elle a été réalisée sur des dérivés substitués en
17a par un groupement éthynyle. Ainsi (voie (a), Van Rheenen et a/., J. Org. Chem.,
1979, 44, 1582-1684) la transposition d'un groupement sulfoxy (R = SPh) donne un
enchaînement allénique dont la fonctionnalisation ultérieure conduira à l'orientation
voulue de la chaîne carbonée. Dans la voie (b), l'hydrolyse de l'ester nitrique
(R = NO2), en présence de sels mercuriques et d'acide formique, s'effectue par un
mécanisme de type SN2, avec inversion de la configuration de C17 (R'=OC(H)=O :
Hofmeister étal., Chem. Ber., 1978,111, 3086-3093).