Page 436 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 436
397
6 GÉNÉRAIJTÉS SUR LES STËRO1DES
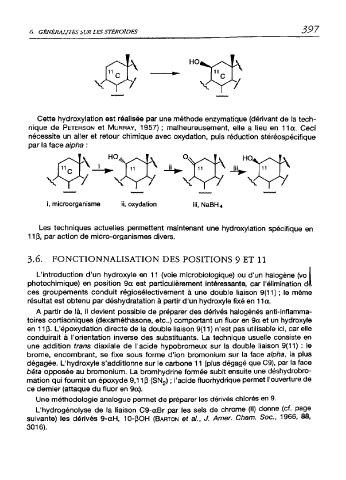
Cette hydroxylation est réalisée par une méthode enzymatique (dérivant de la tech
nique de Peterson et Murray, 1957) ; malheureusement, elle a lieu en 11a. Ceci
nécessite un aller et retour chimique avec oxydation, puis réduction stéréospécifique
par la face alpha :
i, microorganisme ii, oxydation iii, NaBH
Les techniques actuelles permettent maintenant une hydroxylation spécifique en
113, par action de micro-organismes divers.
3.6. FONCTIONNALISATION DES POSITIONS 9 ET 11
L'introduction d'un hydroxyle en 11 (voie microbiologique) ou d'un halogène (vo I
photochimique) en position 9a est particulièrement intéressante, car l'élimination dl
ces groupements conduit régiosélectivement à une double liaison 9(11); le même
résultat est obtenu par déshydratation à partir d'un hydroxyle fixé en 11 a.
A partir de là, il devient possible de préparer des dérivés halogénés anti-inflamma
toires cortisoniques (dexaméthasone, etc..) comportant un fluor en 9a et un hydroxyle
en 11 p. L'époxydation directe de la double liaison 9(11) n'est pas utilisable ici, car elle
conduirait à l'orientation inverse des substituants. La technique usuelle consiste en
une addition trans diaxiale de l'acide hypobromeux sur la double liaison 9(11) : le
brome, encombrant, se fixe sous forme d'ion bromonium sur la face alpha, la plus
dégagée. L'hydroxyle s'additionne sur le carbone 11 (plus dégagé que C9), par la face
bêta opposée au bromonium. La bromhydrine formée subit ensuite une déshydrobro-
mation qui fournit un époxyde 9,113 (SN2) ; l'acide fluorhydrique permet l'ouverture de
ce dernier (attaque du fluor en 9a).
Une méthodologie analogue permet de préparer les dérivés chlorés en 9.
L'hydrogénolyse de la liaison C9-aBr par les sels de chrome (II) donne (cf. page
suivante) les dérivés 9-aH, 10-3OH (Barton et al., J. Amer. Chem. Soc., 1966, 88,
3016).