Page 440 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 440
401
6 GÉNÉRALITÉS SUR LES STÉRO1DES
de 95 %, ce qui est considérable pour une réaction bimoléculaire à catalyse non enzy
matique. La saturation de la double liaison 8(14) de 42 permet d’introduire un hydro
gène en C14 par la face la moins encombrée, en position a. La méthylènecétone 43
obtenue par réaction de Mannich (HCHO, R2NH2) constitue un accepteur de Michaël
pour le cétoester 44 : le dérivé 45, qui possède tous les carbones nécessaires, est
obtenu par formation de la liaison 6,7 ; il est ultérieurement transformé, en plusieurs
étapes, en 19-norandrost-4-ène-3,17-dione 46. D'autres voies permettant d'obtenir la
méthylènecétone 43 ont été décrites par Stork et D'angelo.
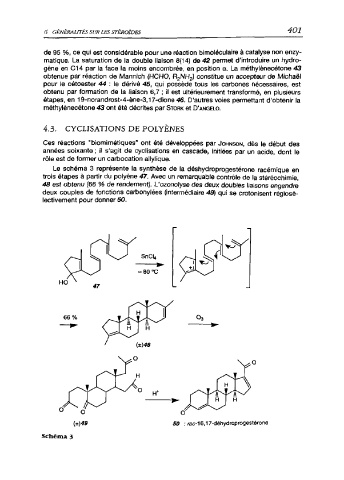
4.3. CYCLISATIONS DE POLYÈNES
Ces réactions “biomimétiques" ont été développées par Johnson, dès le début des
années soixante ; il s'agit de cyclisations en cascade, initiées par un acide, dont le
rôle est de former un carbocation allylique.
Le schéma 3 représente la synthèse de la déshydroprogestérone racémique en
trois étapes à partir du polyène 47. Avec un remarquable contrôle de la stéréochimie,
48 est obtenu (66 % de rendement). L'ozonolyse des deux doubles liaisons engendre
deux couples de fonctions carbonylées (intermédiaire 49) qui se crotonisent régiosé-
lectivement pour donner 50.
(±)49 50 : rac-16,17-déhydroprogestérone
Schéma 3