Page 433 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 433
394 MÉDICAMENTS EN RELA TION A VEC DES SYSTÈMES HORMI .'NA UX
Une réaction, appliquée industriellement par Upjohn, utilise les cyanhydrines de
dérivés 17-céto : l'acide cyanhydrique, molécule de très petite taille, peut s'addition
ner sur les deux faces du groupement carbonylé, donnant les deux cyanhydrines qui
sont en équilibre (1/1) dans l'acide acétique. Mais la cristallisation sélective de l'iso
mère 170-CN permet de déplacer l'équilibre et d'obtenir un rendement de 95 % en
cet isomère qui peut être ultérieurement transformé en dérivé du pregnane (voir par
exemple Livingston et a!., J. Amer. Chem. Soc., 1990, 112, 6449-6450 et les réfé
rences citées).
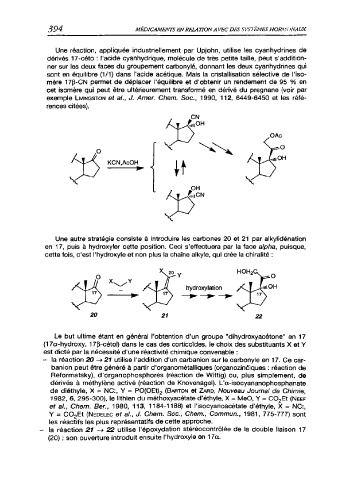
Une autre stratégie consiste à introduire les carbones 20 et 21 par alkylidénation
en 17, puis à hydroxyler cette position. Ceci s’effectuera par la face alpha, puisque,
cette fois, c’est l'hydroxyle et non plus la chaîne alkyle, qui crée la chiralité :
Le but ultime étant en général l’obtention d’un groupe "dihydroxyacétone" en 17
(17a-hydroxy, 17p-cétol) dans le cas des corticoïdes, le choix des substituants X et Y
est dicté par la nécessité d'une réactivité chimique convenable :
- la réaction 20 -> 21 utilise l'addition d'un carbanion sur le carbonylé en 17. Ce car-
banion peut être généré à partir d'organométalliques (organozinôiques : réaction de
Reformatsky), d'organophosphorés (réaction de Wittig) ou, plus simplement, de
dérivés à méthylène activé (réaction de Knovenagel). L'a-isocyananophosphanate
de diéthyle, X = NC:, Y = PO(OEt)2 (Barton et Zard, Nouveau Journal de Chimie,
1982, 6, 295-300), le lithien du méthoxyacétate d'éthyle, X = MeO, Y = CO2Et (Neef
et al., Chem. Ber., 1980, 113, 1184-1188) et l'isocyanoacétate d'éthyle, X = NC:,
Y = CO2Et (Nedelec et al., J. Chem. Soc., Chem., Commun., 1981, 775-777) sont
les réactifs les plus représentatifs de cette approche.
- la réaction 21 -> 22 utilise l'époxydation stéréocontrôlée de la double liaison 17
(20) ; son ouverture introduit ensuite l'hydroxyle en 17a.