Page 119 - 23 Dalton
P. 119
Nmv 2
P=--
3V
Esta expresión relaciona la presión (medible) con la energía cinética promedio
por molécula. Además, es equivalente a la ley empírica de los gases ideales
(PV=nRT), donde se relaciona la energía molecular promedio como propor-
cional con la temperatura, y la constante de Boltzmann con la constante de
los gases (R) y el número de Avogadro.
3000
1
i
2500 -- --~-- --·-·+ - -+---~--+---1--
1
1
!
- J
2000
1
1000 - --
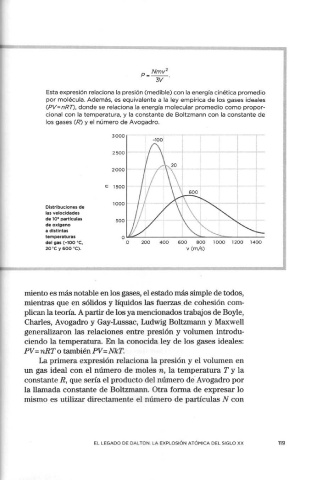
Distribuciones de
las velocidades
de 10 6 partículas
de oxígeno
a distintas
temperaturas o""""::::.._---'-----~---=-------'--
del gas ( -100 ºC, º 200 400 600 800 1000 1200 1400
20 ºC y 600 ºC). v (m/s)
miento es más notable en los gases, el estado más simple de todos,
mientras que en sólidos y líquidos las fuerzas de cohesión com-
plican la teoría. A partir de los ya mencionados trabajos de Boyle,
Charles, Avogadro y Gay-Lussac, Ludwig Boltzmann y Maxwell
generalizaron las relaciones entre presión y volumen introdu-
ciendo la temperatura. En la conocida ley de los gases ideales:
PV = nRT o también PV = NkT.
La primera expresión relaciona la presión y el volumen en
un gas ideal con el número de moles n, la temperatura T y la
constante R, que sería el producto del número de· Avogadro por
la llamada constante de Boltzmann. Otra forma de expresar lo
mismo es utilizar directamente el número de partículas N con
EL LEGADO DE DAL TON. LA EXPLOSIÓN ATÓMICA DEL SIGLO XX 119