Page 18 - MODUL KIMIA
P. 18
Gambar 2.4. Percobaan “tetes minyak” Millikan
Dari penemuannya tersebut, Thomson memperbaiki kelemahan dari teori atom Dalton dan
mengemukakan teori atomnya yang dikenal sebagai Teori Atom Thomson. Menurut Thomson, atom
adalah materi yang bermuatan positif dan didalamnya tersebar elektron (muatan negatif) bagaikan
kismis dalam roti kismis.
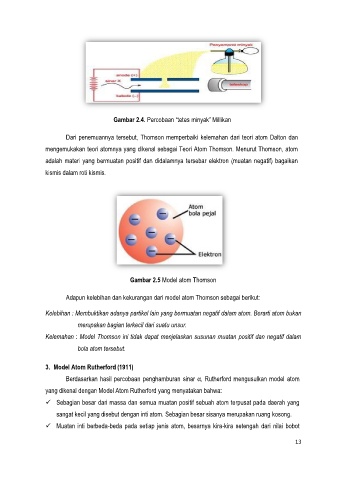
Gambar 2.5 Model atom Thomson
Adapun kelebihan dan kekurangan dari model atom Thomson sebagai berikut:
Kelebihan : Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan
merupakan bagian terkecil dari suatu unsur.
Kelemahan : Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam
bola atom tersebut.
3. Model Atom Rutherford (1911)
Berdasarkan hasil percobaan penghamburan sinar α, Rutherford mengusulkan model atom
yang dikenal dengan Model Atom Rutherford yang menyatakan bahwa:
Sebagian besar dari massa dan semua muatan positif sebuah atom terpusat pada daerah yang
sangat kecil yang disebut dengan inti atom. Sebagian besar sisanya merupakan ruang kosong.
Muatan inti berbeda-beda pada setiap jenis atom, besarnya kira-kira setengah dari nilai bobot
13