Page 281 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 281
12 COMPLEXESDUPLATINE 237
Les déplacements chimiques des protons des ligands azotés ne permettent pas de
différencier les trois complexes, en raison de la très faible amplitude de leur variation
(4,06-4,17 ppm). De même, le couplage observé entre ces protons et le noyau de platine
est très voisin dans les trois composés [la constante J(H, Pt) est comprise entre 62 et
64 Hz]. En revanche, le déplacement chimique du 195 pt est beaucoup plus significatif et
permet de distinguer sans ambiguïté les complexes contenant un environnement oxy-
géné autour de l'atome de platine.
3.3.4. Spectre de masse
Le spectre de masse du cisplatine a été réalisé par ionisation chimique en mode positif
et en mode négatif en transformée de Fourrier (FT-MS). Les spectres présentent un nom-
bre limité de pics d'intensité supérieure à 20 %. Le pic de base apparait au sein d'un
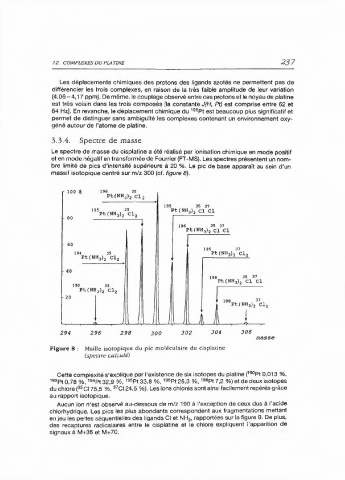
massif isotopique centré sur m/z 300 (cf. figure 8).
100 % 196 35
1
195 35 37
195 35 Pt(NH,), C CI
Pt (NH,), Cl,
80
196 35 37
Pt(NH,), c1 cl
l
60
195 37
194 35 Pt (NH,), Cl,
Pt(NH,), Cl,
40
198 35 37
Pt(NH,), cl cl
192 35
Pt(NH,) Cl,
l Pt(NH 3 ), Cl
20 1 1 98 37
J 1 M ~ !
294 296 298 300 302 304 306
masse
Figure 8 : Maille isotopique du pic moléculaire du cisplatine
(spectre calculé)
Cette complexité s'explique par l'existence de six isotopes du platine (189p 0,013 %,
1
192 p+ 0,78 9, 1 9Pr 32,9 %, 1 8 5 P 33,8 %, 9Pt25,3 9, 198 p7,2 %) et de deux isotopes
du chlore (3 5 Cl 75,5 9," 7 0124,5 %). Les ions chlorés sont ainsi facilement repérés grâce
au rapport isotopique.
Aucun ion n'est observé au-dessous de m/z 190 à l'exception de ceux dus à l'acide
chlorhydrique. Les pics les plus abondants correspondent aux fragmentations mettant
en jeu les pertes séquentielles des ligands Cl et NH , rapportées sur la figure 9. De plus,
3
des recaptures radicalaires entre le cisplatine et le chlore expliquent l'apparition de
signaux à M+35 et M+70.