Page 354 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 354
310 MEDICAMENTS INDUISANTOUSTABILISANTDES COUPURES DE L'ADN
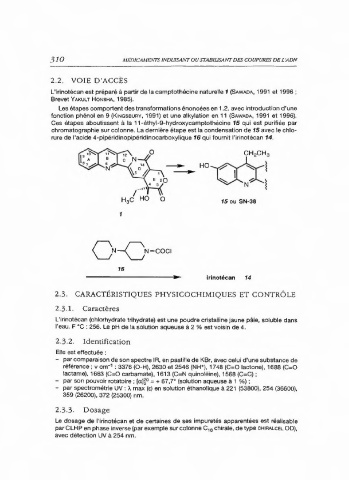
2.2. VOIE D'ACCÈS
L'irinotécan est préparé à partir de la camptothécine naturelle 1 (SA4wADA, 1991 et 1996 ;
Brevet YAKULT HONSHA, 1985).
Les étapes comportent des transformations énoncées en 1.2. avec introduction d'une
fonction phénol en 9 (KrNGSBUAY, 1991) et une alkylation en 11 (SAwADA, 1991 et 1996).
Ces étapes aboutissent à la 11-éthyl-9-hydroxycamptothécine 15 qui est purifiée par
chromatographie sur colonne. La dernière étape est la condensation de 15 avec le chlo-
rure de l'acide 4-pipéridinopipéridinocarboxylique 16 qui fournit l'irinotécan 14.
0
15 ou SN-38
OO
16
irlnotécan 14
2.3. CARACTÉRISTIQUES PHYSICOCHIMIQUES ET CONTRÔLE
2.3.1. Caractères
L'irinotécan (chlorhydrate trihydrate) est une poudre cristalline jaune pâle, soluble dans
l'eau. F °C : 256. Le pH de la solution aqueuse à 2 % est voisin de 4.
2.3.2. Identification
Elle est effectuée :
- par comparaison de son spectre IR, en pastille de KBr, avec celui d'une substance de
référence; v cm': 3376 (O-H), 2630 et 2546 (NH'), 1748 (C=O lactone), 1688 (C=O
lactame), 1663 (C=O carbamate), 1613 (C=N quinoléine), 1568 (C=C);
- par son pouvoir rotatoire ; [a]?°= + 67,7° (solution aqueuse à 1 %);
- par spectrométrie UV : 2 max (e) en solution éthanolique à 221 (53800), 254 (36600),
359 (26200), 372 (25300) nm.
2.3.3. Dosage
Le dosage de l'irinotécan et de certaines de ses impuretés apparentées est réalisable
par CLHP en phase inverse (par exemple sur colonne G, chirale, de type CHIRALCEL OD),
avec détection UV à 254 nm.