Page 363 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 363
14. CAMPTOTHECINE ETDÉRIVES 319
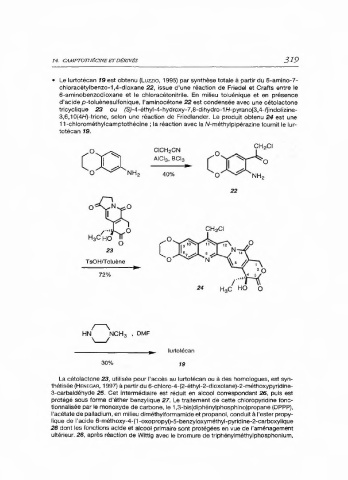
• Le lurtotécan 19 est obtenu (Luzz10, 1995) par synthèse totale à partir du 6-amino-7-
chloracétylbenzo-1,4-dioxane 22, issue d'une réaction de Friedel et Crafts entre le
6-aminobenzodioxane et le chloracétonitrile. En milieu toluénique et en présence
d'acide p-toluènesulfonique, l'aminocétone 22 est condensée avec une cétolactone
tricyclique 23 ou (S)-4-éthyl-4-hydroxy-7,8-dihydro-1H-pyrano[3,4-f]indolizine-
3,6,10(4H)-trione, selon une réaction de Friedlander. Le produit obtenu 24 est une
11-chlorométhylcamptothécine ; la réaction avec la N-méthylpipérazine fournit le lur-
totécan 19.
CICH;CN
AICla. BCla
40%
22
c
23
TsOH/Toluène 0
72%
/
HN NCH, , DMF
\........1
lurtotécan
30% 19
La cétolactone 23, utilisée pour l'accès au lurtotécan ou à des homologues, est syn-
thétisée (HENEGAR, 1997) à partir du 6-chloro-4-(2-éthyl-2-dioxolane)-2-méthoxypyridine-
3-carbaldéhyde 25. Cet intermédiaire est réduit en alcool correspondant 26, puis est
protégé sous forme d'éther benzylique 27. Le traitement de cette chloropyridine fonc-
tionnalisée par le monoxyde de carbone, le 1,3-bis(diphénylphosphino)propane (DPPP),
l'acétate de palladium, en milieu diméthylformamide et propanol, conduit à l'ester propy-
lique de l'acide 6-méthoxy-4-(1-oxopropyl)-5-benzyloxyméthyl-pyridine-2-carboxylique
28 dont les fonctions acide et alcool primaire sont protégées en vue de l'aménagement
ultérieur. 28, après réaction de Wittig avec le bromure de triphénylméthylphosphonium,