Page 649 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 649
609
27. HYDROXYCARBAMIDE ETINHIBITEURS DE LA RIBONUCLÉOTIDE RÉDUCTASE
protéine R1
protéine R2
\ -@-o·
Tyr-122 O<,-Gau-2as
HO HO O
:%8°°°
re Y
Asp-84< O :je' Glu-204
I «€,
N o~o NIÎ
His-1181 ~ Glu-115 N His-241
N ,
H H
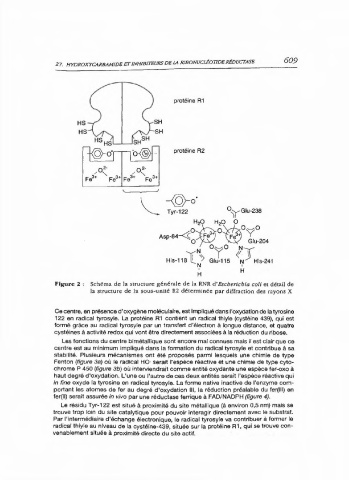
Figure 2 : Schéma de la structure générale de la RNR d'Escherichia coli et détail de
la structure de la sous-unité R2 déterminée par diffraction des rayons X
Ce centre, en présence d'oxygène moléculaire, est Impliqué dans l'oxydation de la tyrosine
122 en radical tyrosyle. La protéine R1 contient un radical thiyle (cystéine 439), qui est
formé grâce au radical tyrosyle par un transfert d'électron à longue distance, et quatre
cystéines à activité redox qui vont être directement associées à la réduction du ribose.
Les fonctions du centre bimétallique sont encore mal connues mais il est clair que ce
centre est au minimum impliqué dans la formation du radical tyrosyle et contribue à sa
stabilité. Plusieurs mécanismes ont été proposés parmi lesquels une chimie de type
Fenton (figure 3a) où le radical HO· serait l'espèce réactive et une chimie de type cyto-
chrome P 450 (figure 3b) où interviendrait comme entité oxydante une espèce fer-oxo à
haut degré d'oxydation. L'une ou l'autre de ces deux entités serait l'espèce réactive qui
ln fine oxyde la tyrosine en radical tyrosyle. La forme native inactive de l'enzyme com-
portant les atomes de fer au degré d'oxydation Ill, la réduction préalable du fer(ll1) en
fer(II) serait assurée in vivo par une réductase ferrique à FAD/NADPH (figure 4).
Le résidu Tyr-122 est situé à proximité du site métallique (à environ 0,5 nm) mais se
trouve trop loin du site catalytique pour pouvoir interagir directement avec le substrat.
Par l'intermédiaire d'échange électronique, le radical tyrosyle va contribuer à former le
radical thiyle au niveau de la cystéine-439, située sur la protéine R1, qui se trouve con-
venablement située à proximité directe du site actif.