Page 740 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 740
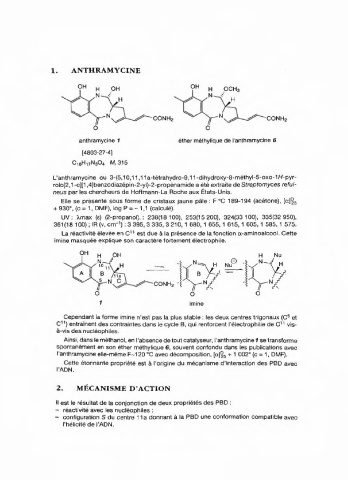
1. ANTHRAMYCINE
anthramycine 1 éther méthylique de l'anthramycine 6
[4803-27-4]
C,eH+7N3O, M, 315
L'anthramycine ou 3-(5,10,11,11a-tétrahydro-9,11-dihydroxy-8-méthyl-5-0x0-1H-pyr-
rolo[2,1-c][1,4]benzodiazépin-2-yl)-2-propénamide a été extraite de Streptomyces refui-
neus par les chercheurs de Hoffmann-La Roche aux États-Unis.
Elle se présente sous forme de cristaux jaune pâle: F "C 189-194 (acétone), [c)%,
+ 930°, (c = 1, DMF), log P =-1,1(calculé).
UV: 2max (e) (2-propanol). : 238(18 100), 253(15 200), 324(33 100), 335(32 950),
361(18 100); IR (v, cm'): 3 395, 3 335, 3 210, 1 680, 1 655, 1 615, 1 605, 1 585, 1 575.
La réactivité élevée en C'' est due à la présence de la fonction a-aminoalcool. Cette
imine masquée explique son caractère fortement électrophile.
imine
Cependant la forme imine n'est pas la plus stable : les deux centres trigonaux (C 5 et
C'') entrainent des contraintes dans le cycle B, qui renforcent l'électrophilie de C'' vis-
à-vis des nucléophiles.
Ainsi, dans le méthanol, en l'absence de tout catalyseur, l'anthramycine 1 se transforme
spontanément en son éther méthylique 6, souvent confondu dans les publications avec
l'anthramycine elle-même F--120 "C avec décomposition, [a)'+ 1 002° (c= 1, DMF).
Cette étonnante propriété est à l'origine du mécanisme d'interaction des PBD avec
l'ADN.
2. MÉCANISME D'ACTION
Il est le résultat de la conjonction de deux propriétés des PBD :
- réactivité avec les nucléophiles ;
- configuration S du centre 11a donnant à la PBD une conformation compatible avec
l'hélicité de l'ADN.