Page 199 - Traité de Chimie Thérapeutique 2 : Médicaments Antibiotiques
P. 199
4. /.ES TI/IÉNAMYCINES 189
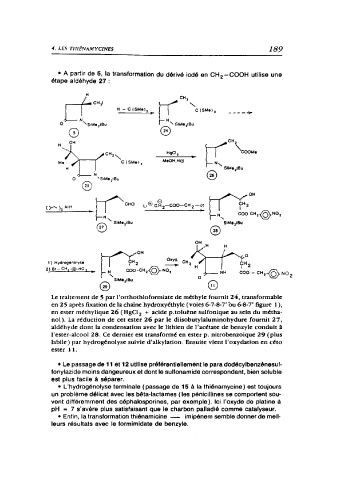
• A partir de 5, la transformation du dérivé iodé en CH -COOH utilise une
2
étape aldéhyde 27 :
/ H CH I CH,
CT 2 H- C(SMo) ' C (SM&), ----->
o '
0 ' S1Ma,1Bu ~ SIM& IBu
v'
H
H)c( CHz'-.,.
O ....,.,
Ma C(SMe), M..0H,H0
H .
0 "sswu,ieo
@
OH
H H
OH !
2 Oxyd. n, •>;e
1 ) Hydrogéno'yse CH,
a ' o· @ OO - CH -©
2) 8r- CH,-@-NO , -CH,0 N-;----
·oo.
Le traitement de 5 par l'orthothioformiate de méthyle fournit 24, transformable
en 25 après fixation de la chaîne hydroxyéthyle (voies 6-7-8-7' ou 6-8-7' figure 1 ),
en ester méthylique 26 (HgCl, + acide p.toluène sulfonlque au sein du métha-
nol). La réduction de cet ester 26 par le diisobutylaluminohydure fournit 27,
aldéhyde dont la condensation avec le lithien de l'acétate de benzyle conduit à
l'ester-alcool 28. Cc dernier est transformé en ester p. nitrobenzoique 29 (plus
labile) par hydrogénolysc suivie d'alkylation. Ensuite vient l'oxydation en céto
ester 11.
• Le passage de 11 et 12 utilise préférentiellement le para dodécylbenzènesul-
fonylazide moins dangeureux et dont le sulfonamide correspondant, bien soluble
est plus facile à séparer.
• L'hydrogénolyse terminale ( passage de 15 à la thiénamycine) est toujours
un problème délicat avec les bêta-lactames ( les pénicillines se comportent sou-
vent différemment des céphalosporines, par exemple). Ici l'oxyde de platine à
pH = 7 s'avère plus satisfaisant que le charbon palladié comme catalyseur.
• Enfin, la transformation thiénamicine - imipénem semble donner de meil-
leurs résultats avec le formimidate de benzyle.