Page 197 - Traité de Chimie Thérapeutique 2 : Médicaments Antibiotiques
P. 197
4. LES THIÉNAMYCINES 187
,
Me~
O
H
H
'•,,, S
H '
MeOH S R D.C.C.
21 SSR
~ COOMe H COOH NH 2 COOMe
OH H..,...--c ,·····H
,..•·: ( Id 9-11 ) Schéma 1 H S R .•
1s f COOMe O NH \
H 0 COQ
CH,
NH
o· e (Q)
@
No,
H
N-COOR S R
1) P03 N-CQOR H
0
NH
0
@
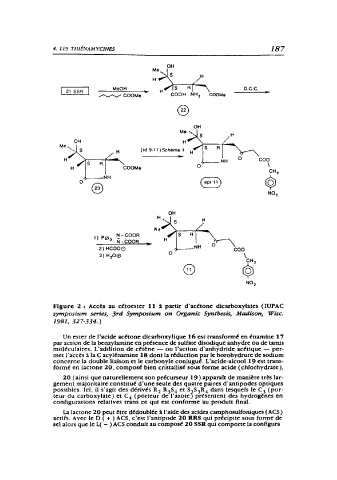
Figure 2 : Accès au cétoester 11 à partir d'acétone dicarboxylates (IUPAC
symposium series, 3rd Symposium on Organic Synthesis, Madison, Wise.
1981, 327-334.)
Un ester de l'acide acétone dicarboxylique 16 est transformé en énarnlne 1 7
par action de la benzyl:unine en présence de sulfate dlsodique anhydre ou de tamis
moléculaires. L'addition de cétène - ou l'action d'anhydride acétique - per-
met l'accès à la C acylénamine 18 dont la réduction par le borohydrure de sodium
concerne la double liaison et le carbonyle conjugué. L'acide-alcool 19 est trans-
formé en lactone 20, composé bien cristallisé sous forme acide (chlorhydrate).
20 ( ainsi que naturellement son précurseur 19) apparaît de manière très lar-
gement majoritaire constitué d'une seule des quatre paires d'antipodes optiques
possibles. Ici, il s'agit des dérivés R, R4S ct 8,S4R, dans lesquels le C (por-
4
3
teur du carboxylate) et c 4 (porteur de l'azote) présentent des hydrogènes en
configurations relatives trans ce qui est conforme au produit final.
La lactone 20 peut être dédoublée à l'aide des acides camphosulfoniqucs ( ACS)
actifs. Avec le D ( +) ACS, c'est l'antipode 20 RRS qui précipite sous forme de
sel alors que le L( - ) ACS conduit au composé 20 SSR qui comporte la configura