Page 317 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 317
278 MÉDICAMENTS EN REIA TION A VEC DES SYSTÈMES HORMONA UX
16.2. VOIE D’ACCÈS
16.2.1. Stratégies mises en œuvre
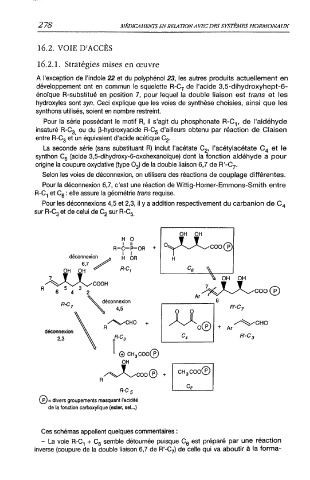
A l'exception de l'indole 22 et du polyphénol 23, les autres produits actuellement en
développement ont en commun le squelette R-C7 de l'acide 3,5-dihydroxyhept-6-
énoïque R-substitué en position 7, pour lequel la double liaison est trans et les
hydroxyles sont syn. Ceci explique que les voies de synthèse choisies, ainsi que les
synthons utilisés, soient en nombre restreint.
Pour la série possédant le motif R, il s'agit du phosphonate R-Cp de l'aldéhyde
insaturé R-C3 ou du 0-hydroxyacide R-C5 d'ailleurs obtenu par réaction de Claisen
entre R-C3 et un équivalent d'acide acétique C2.
La seconde série (sans substituant R) inclut l'acétate C2, l'acétylacétate C4 et le
synthon C6 (acide 3,5-dihydroxy-6-oxohexanoïque) dont la fonction aldéhyde a pour
origine la coupure oxydative (type O3) de la double liaison 6,7 de R'-C7.
Selon les voies de déconnexion, on utilisera des réactions de couplage différentes.
Pour la déconnexion 6,7, c'est une réaction de Wittig-Horner-Emmons-Smith entre
R-C1 et C6 : elle assure la géométrie trans requise.
Pour les déconnexions 4,5 et 2,3, il y a addition respectivement du carbanion de C4
sur R-C3 et de celui de C2 sur R-C5
(?)= divers groupements masquant l'acidité
de la fonction carboxylique (ester, sel...)
Ces schémas appellent quelques commentaires :
- La voie R-C1 + C6 semble détournée puisque C6 est préparé par une réaction
inverse (coupure de la double liaison 6,7 de R'-C7) de celle qui va aboutir à la forma