Page 318 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 318
4. LES NORMOLIPfiMIANTS 279
tion de R-C7. Ceci tient au fait qu'il n'est pas possible de coupler R-C3 à C4 si l'aldé
hyde R-C3 est (homo)énolisable (polymérisation), ce qui justifie l'utilisation d'un substi
tuant arylique dans R'-C7.
- Le couplage de R-C3 (ou de R'-C3) avec C4 se fait nécessairement à partir du di-
anion de C4, qui permet d'assurer la régiosélectivité du couplage entre la position 4
de C3 et le groupement carbonylé (le mono-anion donnerait le couplage avec la posi
tion 2).
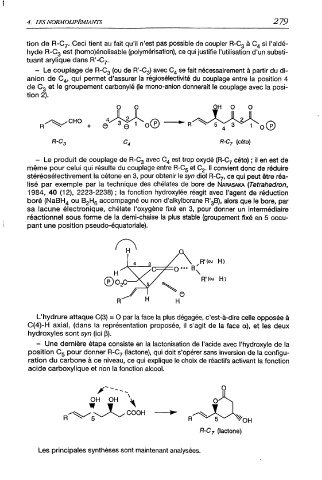
- Le produit de couplage de R-C3 avec C4 est trop oxydé (R-C7 céto) ; il en est de
même pour celui qui résulte du couplage entre R-C5 et C2. Il convient donc de réduire
stéréosélectivement la cétone en 3, pour obtenir le syn diol R-C7, ce qui peut être réa
lisé par exemple par la technique des chélates de bore de Narasaka (Tetrahedron,
1984, 40 (12), 2223-2238) ; la fonction hydroxylée réagit avec l'agent de réduction
boré (NaBH4 ou B2H6 accompagné ou non d'alkylborane R'3B), alors que le bore, par
sa lacune électronique, chélate l'oxygène fixé en 3, pour donner un intermédiaire
réactionnel sous forme de la demi-chaise la plus stable (groupement fixé en 5 occu
pant une position pseudo-équatoriale).
L'hydrure attaque C(3) = O par la face la plus dégagée, c'est-à-dire celle opposée à
C(4)-H axial, (dans la représentation proposée, il s'agit de la face a), et les deux
hydroxyles sont syn (ici £).
- Une dernière étape consiste en la lactonisation de l'acide avec i'hydroxyle de la
position C5 pour donner R-C7 (lactone), qui doit s'opérer sans inversion de la configu
ration du carbone à ce niveau, ce qui explique le choix de réactifs activant la fonction
acide carboxylique et non la fonction alcool.
Les principales synthèses sont maintenant analysées.