Page 413 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 413
374 MÉDICAMENTS EN R FIA DON AVEC DES 5 > STÉ\ 1ES HORS ! I INA UX
B A
— -------------
c
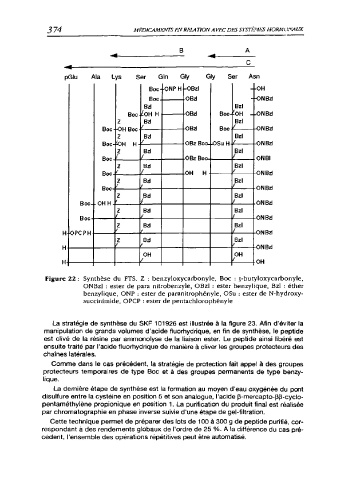
pGlu Ala Lys Ser Gin Gly Gly Ser Asn
Boc- ONP H -OBzl -OH
OBd -ON Bd
Bzl Bzl
DÜU OBd DUlz“ on Bd
Z Bd Bzl
DOC •OBd Boc -on Bd
Z zBzf Bzl
Boc- OBz Boc- H' / -ON Rd
Z Bzl Bzl
Pah f / / ONBI
Z Bd Bzl
Rno / OH H ■ / -ON Bd
Z Bd Bzl
DOC” t f QN Bd
Z Bd Bzl
OH H. ! f ON Bd
Z 3A Bzl
DOC- / l -ON Bd
Z Bd Bzl
H OPCP H f / •ONBd
Z Bd zBzl
•ON Bd
OH OH
H- / OH
Figure 22 : Synthèse du FTS. Z : benzyloxycarbonyle, Boc : j-butyloxycarbonyle,
ONBzl : ester de para nitrobenzyle, OBzl : ester benzylique, Bzl : éther
benzylique, ONP : ester de paranitrophényle, OSu : ester de N-hydroxy-
succinimide, OPCP : ester de pentachlorophényle
La stratégie de synthèse du SKF 101926 est illustrée à la figure 23. Afin d'éviter la
manipulation de grands volumes d'acide fluorhydrique, en fin de synthèse, le peptide
est clivé de la résine par ammonolyse de la liaison ester. Le peptide ainsi libéré est
ensuite traité par l'acide fluorhydrique de manière à cliver les groupes protecteurs des
chaînes latérales.
Comme dans le cas précédent, la stratégie de protection fait appel à des groupes
protecteurs temporaires de type Boc et à des groupes permanents de type benzy
lique.
La dernière étape de synthèse est la formation au moyen d'eau oxygénée du pont
disulfure entre la cystéine en position 5 et son analogue, l'acide p-mercapto-pp-cyclo-
pentaméthylène propionique en position 1. La purification du produit final est réalisée
par chromatographie en phase inverse suivie d'une étape de gel-filtration.
Cette technique permet de préparer des lots de 100 à 300 g de peptide purifié, cor
respondant à des rendements globaux de l'ordre de 25 %. A la différence du cas pré
cédent, l’ensemble des opérations répétitives peut être automatisé.