Page 472 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 472
7. ESTROGÈNES 433
éthinylestradiol
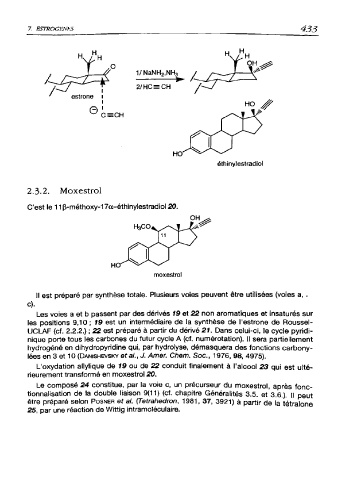
2.3.2. Moxestrol
C'est le 11 p-méthoxy-17a-éthinylestradiol 20.
moxestrol
Il est préparé par synthèse totale. Plusieurs voies peuvent être utilisées (voies a, .
c).
Les voies a et b passent par des dérivés 19 et 22 non aromatiques et insaturés sur
les positions 9,10 ; 19 est un intermédiaire de la synthèse de l'estrone de Roussel-
UCLAF (cf. 2.2.2.) ; 22 est préparé à partir du dérivé 21. Dans celui-ci, le cycle pyridi
nique porte tous les carbones du futur cycle A (cf. numérotation). Il sera partiellement
hydrogéné en dihydropyridine qui, par hydrolyse, démasquera des fonctions carbony-
lées en 3 et 10 (Danishevsky et al., J. Amer. Chem. Soc., 1976, 98, 4975).
L'oxydation allylique de 19 ou de 22 conduit finalement à l'alcool 23 qui est ulté
rieurement transformé en moxestrol 20.
Le composé 24 constitue, par la voie c, un précurseur du moxestrol, après fonc
tionnalisation de la double liaison 9(11) (cf. chapitre Généralités 3.5. et 3.6.). Il peut
être préparé selon Posner et al. (Tetrahedron, 1981, 37, 3921) à partir de la tétralone
25, par une réaction de Wittig intramoléculaire.