Page 468 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 468
7. ESTROGÈNES 429
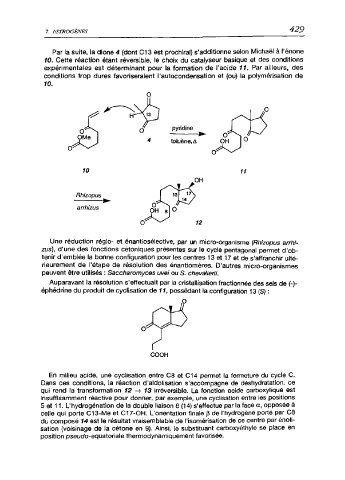
Par la suite, la dione 4 (dont C13 est prochiral) s'additionne selon Michaël à l'énone
10. Cette réaction étant réversible, le choix du catalyseur basique et des conditions
expérimentales est déterminant pour la formation de l’acide 11. Par ailleurs, des
conditions trop dures favoriseraient l'autocondensation et (ou) la polymérisation de
10.
Une réduction régie- et énantiosélectlve, par un micro-organisme (Rhizopus arrhi-
zus), d'une des fonctions cétoniques présentes sur le cycle pentagonal permet d'ob
tenir d'emblée la bonne configuration pour les centres 13 et 17 et de s'affranchir ulté
rieurement de l’étape de résolution des énantiomères. D'autres micro-organismes
peuvent être utilisés : Saccharomyces uvei ou S. chevalierii.
Auparavant la résolution s'effectuait par la cristallisation fractionnée des sels de (-)-
éphédrine du produit de cyclisation de 11, possédant la configuration 13 (S) :
COOH
En milieu acide, une cyclisation entre C8 et C14 permet la fermeture du cycle C.
Dans ces conditions, la réaction d'aldolisation s'accompagne de déshydratation, ce
qui rend la transformation 12 13 irréversible. La fonction acide carboxylique est
insuffisamment réactive pour donner, par exemple, une cyclisation entre les positions
5 et 11. L'hydrogénation de la double liaison 8 (14) s'effectue par la face a, opposée à
celle qui porte C13-Me et C17-0H. L'orientation finale p de l'hydrogène porté par C8
du composé 14 est le résultat vraisemblable de l'isomérisation de ce centre par énoli
sation (voisinage de la cétone en 9). Ainsi, le substituant carboxyéthyle se place en
position pseudo-équatoriale thermodynamiquement favorisée.