Page 90 - E-BOOK KIMIA ANALITIK
P. 90
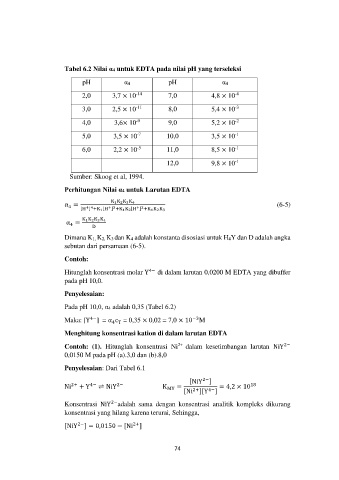
Tabel 6.2 Nilai α4 untuk EDTA pada nilai pH yang terseleksi
pH α4 pH α4
2,0 3,7 × 10 -14 7,0 4,8 × 10 -4
3,0 2,5 × 10 -11 8,0 5,4 × 10 -3
4,0 3,6× 10 -9 9,0 5,2 × 10 -2
-7
5,0 3,5 × 10 10,0 3,5 × 10 -1
6,0 2,2 × 10 -5 11,0 8,5 × 10 -1
12,0 9,8 × 10 -1
Sumber: Skoog et al, 1994.
Perhitungan Nilai α4 untuk Larutan EDTA
α = K 1 K 2 K 3 K 4 (6-5)
4
+ 3
+ 4
+ 2
[H ] +K 1 [H ] +K 1 K 2 [H ] +K 1 K 2 K 3
α = K 1 K 2 K 3 K 4
4
D
Dimana K1, K2, K3 dan K4 adalah konstanta disosiasi untuk H4Y dan D adalah angka
sebutan dari persamaan (6-5).
Contoh:
Hitunglah konsentrasi molar Y 4− di dalam larutan 0,0200 M EDTA yang dibuffer
pada pH 10,0.
Penyelesaian:
Pada pH 10,0, α4 adalah 0,35 (Tabel 6.2)
−3
Maka: [Y 4− ] = α c = 0,35 × 0,02 = 7,0 × 10 M
4 T
Menghitung konsentrasi kation di dalam larutan EDTA
Contoh: (1). Hitunglah konsentrasi Ni 2+ dalam kesetimbangan larutan NiY 2−
0,0150 M pada pH (a).3,0 dan (b).8,0
Penyelesaian: Dari Tabel 6.1
[NiY 2− ]
18
Ni 2+ + Y 4− ⇌ NiY 2− K = = 4,2 × 10
MY
[Ni ][Y 4− ]
2+
Konsentrasi NiY 2− adalah sama dengan konsentrasi analitik kompleks dikurang
konsentrasi yang hilang karena terurai, Sehingga,
2+
[NiY 2− ] = 0,0150 − [Ni ]
74