Page 126 - 19 Marie Curie
P. 126
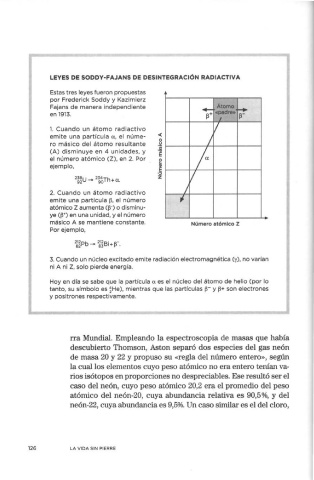
LEYES DE SODDY-FAJANS DE DESINTEGRACIÓN RADIACTIVA
Estas tres leyes fueron propuestas
por Frederick Soddy y Kazimierz
Fajans de manera independiente +- Átomo .....
en 1913. ~+ «padre» ~-
I
l. Cuando un átomo radiactivo V
emite una partícula a, el núme- < /
o
u
ro másico del átomo resultante ·¡¡;
(A) disminuye en 4 unidades, y ·ro
E
el número atómico (Z), en 2. Por o f
ejemplo, cii
E
,:,
z V
/
2. Cuando un átomo radiactivo
emite una partícula ~. el número ;
atómico Z aumenta e~-) o disminu-
ye CW) en una unidad, y el número
másico A se mantiene constante. Número atómico z
Por ejemplo,
3. Cuando un núcleo excitado emite radiación electromagnética (y), no varían
ni A ni Z, solo pierde energía.
Hoy en día se sabe que la partícula a es el núcleo del átomo de helio (por lo
tanto, su símbolo es ~He), mientras que las partículas ~- y ~+ son electrones
y positrones respectivamente.
rra Mundial. Empleando la espectroscopia de masas que había
descubierto Thomson, Astan separó dos especies del gas neón
de masa 20 y 22 y propuso su «regla del número entero», según
la cual los elementos cuyo peso atómico no era entero tenían va-
rios isótopos en proporciones no despreciables. Ese resultó ser el
caso del neón, cuyo peso atómico 20,2 era el promedio del peso
atómico del neón-20, cuya abundancia relativa es 90,5 %, y del
neón-22, cuya abundancia es 9,5%. Un caso similar es el del cloro,
126 LA VIDA SIN PIERRE