Page 167 - Efavirenz WHO PQ: A case study of a public-private collaboration
P. 167
บทที่ 6 ผลการศึกษาและอภิปรายผล ส่วนที่ 3: แนวปฏิบัติในการผลิตยาเพื่อรับการรับรอง WHO PQ | 149
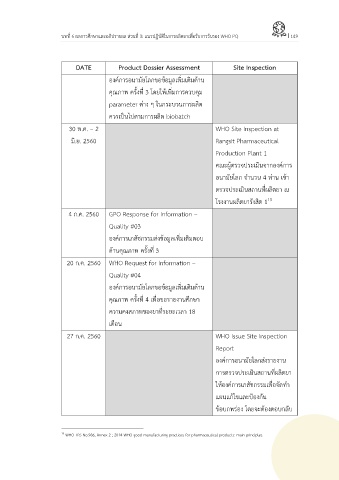
DATE Product Dossier Assessment Site Inspection
องค์การอนามัยโลกขอข้อมูลเพิ่มเติมด้าน
คุณภาพ ครั้งที่ 3 โดยให้เพิ่มการควบคุม
parameter ต่าง ๆ ในกระบวนการผลิต
ควรเป็นไปตามการผลิต biobatch
30 พ.ค. – 2 WHO Site Inspection at
มิ.ย. 2560 Rangsit Pharmaceutical
Production Plant 1
คณะผู้ตรวจประเมินจากองค์การ
อนามัยโลก จ านวน 4 ท่าน เข้า
ตรวจประเมินสถานที่ผลิตยา ณ
โรงงานผลิตยารังสิต 1
13
4 ก.ค. 2560 GPO Response for Information –
Quality #03
องค์การเภสัชกรรมส่งข้อมูลเพิ่มเติมตอบ
ด้านคุณภาพ ครั้งที่ 3
20 ก.ค. 2560 WHO Request for Information –
Quality #04
องค์การอนามัยโลกขอข้อมูลเพิ่มเติมด้าน
ื่
คุณภาพ ครั้งที่ 4 เพอขอรายงานศึกษา
ความคงสภาพของยาที่ระยะเวลา 18
เดือน
27 ก.ค. 2560 WHO Issue Site Inspection
Report
องค์การอนามัยโลกส่งรายงาน
การตรวจประเมินสถานที่ผลิตยา
ให้องค์การเภสัชกรรมเพื่อจัดท า
แผนแก้ไขและป้องกัน
ข้อบกพร่อง โดยจะต้องตอบกลับ
13 WHO TRS No.986, Annex 2 ; 2014 WHO good manufacturing practices for pharmaceutical products: main principles.