Page 162 - Efavirenz WHO PQ: A case study of a public-private collaboration
P. 162
Efavirenz WHO PQ: กรณีศึกษาความร่วมมือรัฐ-เอกชน ในการถ่ายทอดเทคโนโลยีการผลิตและควบคุมคุณภาพ | 144
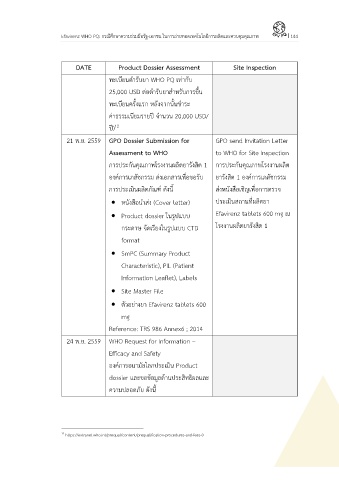
DATE Product Dossier Assessment Site Inspection
ทะเบียนต ารับยา WHO PQ เท่ากับ
25,000 USD ต่อต ารับยาส าหรับการขึ้น
ทะเบียนครั้งแรก หลังจากนั้นช าระ
ค่าธรรมเนียมรายปี จ านวน 20,000 USD/
ปี)
12
21 พ.ย. 2559 GPO Dossier Submission for GPO send Invitation Letter
Assessment to WHO to WHO for Site Inspection
การประกันคุณภาพโรงงานผลิตยารังสิต 1 การประกันคุณภาพโรงงานผลิต
องค์การเภสัชกรรม ส่งเอกสารเพื่อขอรับ ยารังสิต 1 องค์การเภสัชกรรม
การประเมินผลิตภัณฑ์ ดังนี้ ส่งหนังสือเชิญเพื่อการตรวจ
หนังสือน าส่ง (Cover letter) ประเมินสถานที่ผลิตยา
Product dossier ในรูปแบบ Efavirenz tablets 600 mg ณ
กระดาษ จัดเรียงในรูปแบบ CTD โรงงานผลิตยารังสิต 1
format
SmPC (Summary Product
Characteristic), PIL (Patient
Information Leaflet), Labels
Site Master File
ตัวอย่างยา Efavirenz tablets 600
mg
Reference: TRS 986 Annex6 ; 2014
24 พ.ย. 2559 WHO Request for Information –
Efficacy and Safety
องค์การอนามัยโลกประเมิน Product
dossier และขอข้อมูลด้านประสิทธิผลและ
ความปลอดภัย ดังนี้
12 https://extranet.who.int/prequal/content/prequalification-procedures-and-fees-0