Page 181 - Efavirenz WHO PQ: A case study of a public-private collaboration
P. 181
บทที่ 6 ผลการศึกษาและอภิปรายผล ส่วนที่ 3: แนวปฏิบัติในการผลิตยาเพื่อรับการรับรอง WHO PQ | 163
ิ่
2.3 ได้ความรู้เพมเติมเกี่ยวกับแนวทาง หรือมาตรฐานข้อก าหนดส าหรับการตรวจ
คุณภาพด้านบรรจุภัณฑ ์
2.4 ได้พฒนาปรับปรุงกระบวนการคิดวิเคราะห์ การท างานให้เป็นไปตามมาตรฐาน
ั
ระดับสากล
2.5 ได้แนวคิดวิธีการในการตอบแผนการแก้ไขและป้องกันข้อบกพร่อง รวมทั้งวิธีการ
รวบรวมและสรุปข้อมูล เพื่อสนับสนุนการตอบข้อบกพร้องภายหลังการตรวจประเมิน
2.6 การ investigation ในกรณีเมื่อเกิดปัญหา ได้เรียนรู้แนวทาง ขั้นตอน และ
รายละเอียดที่ส าคัญที่ต้องท าการพิสูจน์ และการเขียนรายงานที่ครบถ้วน
2.7 การพจารณาข้อก าหนด และวิธีการทดสอบ (specification, test method)
ิ
ี
ื้
พบว่าว่าในแต่ละรายละเอยด แม้จุดเล็กน้อย หรือหัวข้อทดสอบพนฐานล้วนมีความส าคัญต่อการ
วิเคราะห์ทั้งหมด ควรจะท าการทดลอง หรือพิสูจน์จนมั่นใจว่าสามารถน ามาใช้ได้อย่างถูกต้อง
2.8 ได้เรียนรู้แนวทางในการตอบ CAPA ที่สมเหตุสมผล และสามารถป้องกันปัญหาที่
จะเกิดขึ้นในอนาคต และสามารถจัดการปัญหาที่เกิดขึ้นในอดีตได้ครบถ้วน
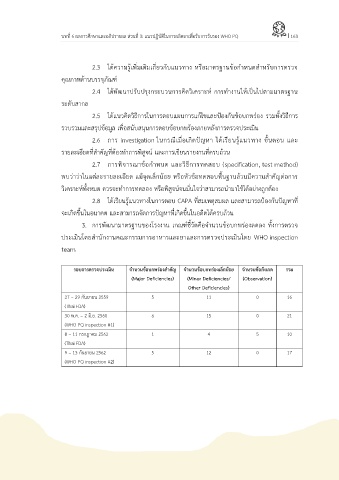
3. การพฒนามาตรฐานของโรงงาน เกณฑ์ชี้วัดคือจ านวนข้อบกพร่องลดลง ทั้งการตรวจ
ั
ประเมินโดยส านักงานคณะกรรมการอาหารและยาและการตรวจประเมินโดย WHO inspection
team
รอบการตรวจประเมิน จ านวนข้อบกพร่องส าคัญ จ านวนข้อบกพร่องเล็กน้อย จ านวนข้อสังเกต รวม
(Major Deficiencies) (Minor Deficiencies/ (Observation)
Other Deficiencies)
27 – 29 กันยายน 2559 5 11 0 16
(Thai FDA)
30 พ.ค. – 2 มิ.ย. 2560 6 15 0 21
(WHO PQ inspection #1)
8 – 11 กรกฎาคม 2562 1 4 5 10
(Thai FDA)
9 – 13 กันยายน 2562 5 12 0 17
(WHO PQ inspection #2)