Page 18 - Modul Asam Basa Kelas XI
P. 18
-
Berdasarkan jumlah jumlah ion OH yang dilepaskan, basa
dikelompokkan sebagai berikut.
-
a) Basa bervalensi satu, yaitu basa yang melepaskan satu ion OH jika
dilarutkan dalam air. Contoh: NaOH, KOH, dan AgOH.
-
b) Basa bervalensi dua, yaitu basa yang melepaskan dua ion OH jika
dilarutkan dalam air. Contoh: Mg(OH)2, Ba(OH)2, dan Ca(OH)2.
-
c) Basa bervalensi tiga, yaitu basa yang melepaskan tiga ion OH jika
dilarutkan dalam air. Contoh: Al(OH)3, Cr(OH)3, dan Fe(OH)3.
Berikut ini diberikan beberapa contoh senyawa basa beserta reaksi
ionisasinya.
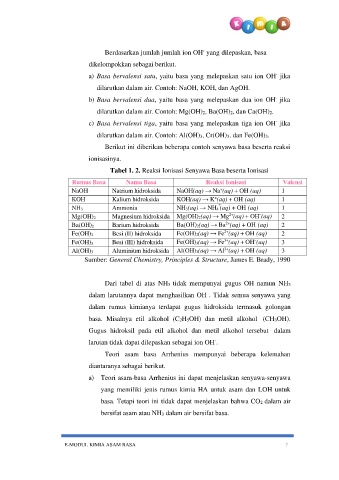
Tabel 1. 2. Reaksi Ionisasi Senyawa Basa beserta Ionisasi
Rumus Basa Nama Basa Reaksi Ionisasi Valensi
NaOH Natrium hidroksida NaOH(aq) → Na (aq) + OH (aq) 1
–
+
+
KOH Kalium hidroksida KOH(aq) → K (aq) + OH (aq) 1
–
+
–
NH3 Ammonia NH3(aq) → NH4 (aq) + OH (aq) 1
–
2+
Mg(OH)2 Magnesium hidroksida Mg(OH)2(aq) → Mg (aq) + OH (aq) 2
–
2+
Ba(OH)2 Barium hidroksida Ba(OH)2(aq) → Ba (aq) + OH (aq) 2
2+
–
Fe(OH)2 Besi (II) hidroksida Fe(OH)2(aq) → Fe (aq) + OH (aq) 2
3+
–
Fe(OH)3 Besi (III) hidroksida Fe(OH)3(aq) → Fe (aq) + OH (aq) 3
3+
–
Al(OH)3 Aluminium hidroksida Al(OH)3(aq) → Al (aq) + OH (aq) 3
Sumber: General Chemistry, Principles & Structure, James E. Brady, 1990
Dari tabel di atas NH3 tidak mempunyai gugus OH namun NH3
–
dalam larutannya dapat menghasilkan OH . Tidak semua senyawa yang
dalam rumus kimianya terdapat gugus hidroksida termasuk golongan
basa. Misalnya etil alkohol (C2H5OH) dan metil alkohol (CH3OH).
Gugus hidroksil pada etil alkohol dan metil alkohol tersebut dalam
-
larutan tidak dapat dilepaskan sebagai ion OH .
Teori asam basa Arrhenius mempunyai beberapa kelemahan
diantaranya sebagai berikut.
a) Teori asam-basa Arrhenius ini dapat menjelaskan senyawa-senyawa
yang memiliki jenis rumus kimia HA untuk asam dan LOH untuk
basa. Tetapi teori ini tidak dapat menjelaskan bahwa CO2 dalam air
bersifat asam atau NH3 dalam air bersifat basa.
E-MODUL KIMIA ASAM BASA 7