Page 177 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 177
8. MllOMYCLNE C 133
sel"
g H,N,Jl -(OCON;;;---r•
2
H
H N~O
j j OMe • MeOH
Me N NH Me " I ,/N
'N
[;NH
0 0
[Ml+• m/z 334 (12%) [M • MeOHl+· m/z 302 (100%)
O CH2 7+·
3-1e
H2N~
1 1
Me N NH -MeO
0
[[Mt" - H2NCOOHl
m/z 273 (73%)
H
C
H2N*
O
2
1 1 ~ 0
we "_W»
0
m/z 242 (100%)
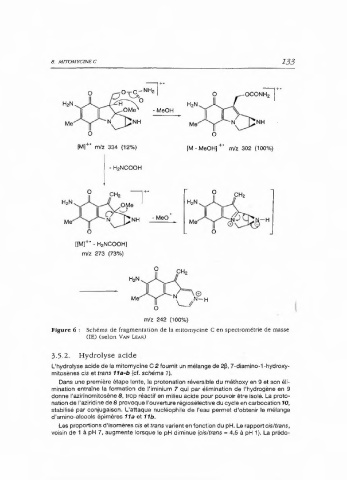
Figure 6 : Schéma de fragmentation de la mitomycine C en spectrométrie de masse
(IE) (selon VAN LEAR)
3.5.2. Hydrolyse acide
L'hydrolyse acide de la mitomycine C 2 fournit un mélange de 2, 7-diamino-1-hydroxy-
mitosènes cis et trans 11a-b (cf. schéma 1).
Dans une première étape lente, la protonation réversible du méthoxy en 9 et son éli-
mination entraîne la formation de l'iminium 7 qui par élimination de l'hydrogène en 9
donne l'azirinomitosène 8, trop réactif en milieu acide pour pouvoir être isolé. La proto-
nation de l'aziridine de 8 provoque l'ouverture régiosélective du cycle en carbocation 10,
stabilisé par conjugaison. L'attaque nucléophile de l'eau permet d'obtenir le mélange
d'amino-alcools épimères 11a et 11b.
Les proportions d'isomères cis et trans varient en fonction du pH. Le rapport cisltrans,
voisin de 1à pH 7, augmente lorsque le pH diminue (cis/trans = 4,5 à pH 1). La prédo-