Page 204 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 204
160 MÉDICAMENTINDUISANTDES MODIFICA770NS COVALENTES DEL 'ADN
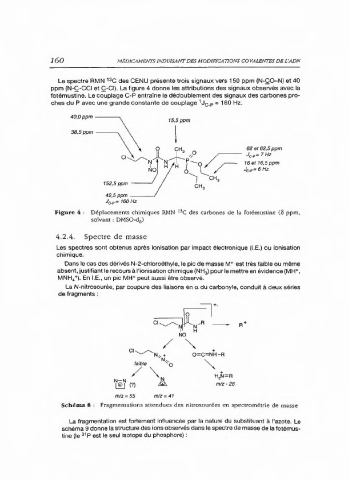
Le spectre RMN 13 C des CENU présente trois signaux vers 150 ppm (N-ÇO-N) et 40
ppm (N-Ç-CCI et Ç-CI). La figure 4 donne les attributions des signaux observés avec la
fotémustine. Le couplage C-P entraine le dédoublement des signaux des carbones pro-
1
ches du P avec une grande constante de couplage Jc.p = 160 Hz.
Figure 4 : Déplacements chimiques RMN C des carbones de la fotémustine (6 ppm,
solvant : DMSO-d )
6
4.2.4. Spectre de masse
Les spectres sont obtenus après ionisation par impact électronique (I.E.) ou ionisation
chimique.
Dans le cas des dérivés N-2-chloroéthyle, le pic de masse M+- est très faible ou même
absent, justifiant le recours à l'ionisation chimique (NH,) pour le mettre en évidence (MH,
MNH,'). En I.E., un pic MH peut aussi être observé.
La N-nitrosourée, par coupure des liaisons en c du carbonyle, conduit à deux séries
de fragments :
.=T'
Cl~ N~ N~R -
1 H
NO
a +
N._+ ""' O=C=NH-R
6e "
\ ""' +
N-N N H,N=R
~ (?) ,fil, mvz- 28
m/z= 55 mlz= 41
Schéma 8 : Fragmentations attendues des nitrosourées en spectrométrie de masse
La fragmentation est fortement influencée par la nature du substituant à l'azote. Le
schéma 9 donne la structure des ions observés dans le spectre de masse de la fotémus-
tine (le 31 P est le seul isotope du phosphore):