Page 205 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 205
9. NITROSOUIŒES 161
fl
H 0-;;l + :,P,
/
,,P...___ H,C,O OH
H,c,o OH mlz= 109
mlz=111 mlz= 138 (60 %)
(35%) (57%)
\ /
7 +.
Q çH, 9 H,
Cl )l,,,l_ Cl )l.A.+
N Oocy), " 'N Pooc,+,
mlz=316 NO NO
(5%)
M+. mlz=315 mlz=270
(0%) (25%)
l •HNO
Q çH,
Cl~ )l A +
mlz = 208 -.....,: c,H °"N N H P(O)OC.H
,..,
1 4
)
. CO / ( 00%\ ",,,. yH,
0 mlz=239
/ ~c,+A._ ,,o (25 %)
'NH r-oH
H, mlz= 1800C,H,
H,JrP(O)(OC,H,)2 (23 %)
mlz= 152
(55%)
mlz= 180 CH
(23%) 0~ + 1 3 O
C, :-'--... ,,
'NH ~-OH
oc,H, ! ·CO
HN' -o (7%)
mlz 164 çH,
(10%) mlz= 124
+.J.__ ,o·
OH
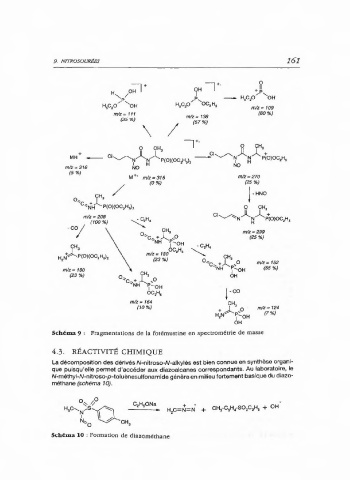
Schéma 9 : Fragmentations de la fotémustine en spectrométrie de masse
4.3. RÉACTIVITÉ CHIMIQUE
La décomposition des dérivés N-nitroso-N-alkylés est bien connue en synthèse organi-
que puisqu'elle permet d'accéder aux diazoalcanes correspondants. Au laboratoire, le
N-méthyl-N-nitroso-p-toluènesulfonamide génère en milieu fortement basique du diazo-
méthane (schéma 10).
o.°
H,c, /s'°'
< f c,
Schéma 10: Formation de diazométhane