Page 413 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 413
369
16. ANTHRACYCLUNES UTILISEES EN 71i0?APEIJTJQCJE
Brwo
6
.
H,Co. OCH Il
+ 1 C I D 'CH, nBuU,THF
69%
H,CO 'OCH 3
26
1) SnCI, CH,COOHH,O 0 r ~ Jl
0
2) NaOH, CH,OH, H,O
Jl ~ I 'CH3
3) CH,SO,H ou HF
30% ,! (
H,CO OH
27
(-t)2s
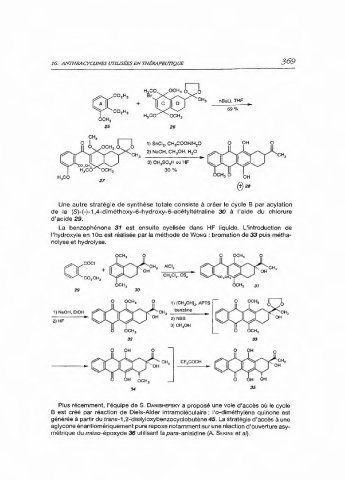
Une autre stratégie de synthèse totale consiste à créer le cycle B par acylation
de la (S)-(-)-1,4-diméthoxy-6-hydroxy-6-acétyltétraline 30 à l'aide du chlorure
d'acide 29.
La benzophénone 31 est ensuite cyclisée dans HF liquide. L'introduction de
!'hydroxyle en 1 Oet est réalisée par la méthode de WoNG : bromation de 33 puis métha-
nolyse et hydrolyse.
(X COCI +
CO,CH,
29
1)(CH,OH),,APTS~~b
b
c
,
o
o
H
1) NaOH, EtOH benzène ~ --::, ,. CH,
2)NBS :::,,,_ 1 l. "o
2)HF
3) CH,OH
H,
sr·l CF,COOH
33
r'J
:u
Plus récemment, l'équipe de S. DANISHEFSKY a proposé une voie d'accès où le cycle
B est créé par réaction de Diels-Alder intramoléculaire : l'o-diméthylène quinone est
générée à partir du trans-1,2-disilyloxybenzocyclobutène 45. La stratégie d'accès à une
aglycone énantiomériquement pure repose notamment sur une réaction d'ouverture asy-
métrique du méso-époxyde 36 utilisant la para-anisidine (A. SEKINE et a().