Page 428 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 428
384 MEDICAMENTS INDUISANT OU STABILISANT DES COUPURES DE L'ADN
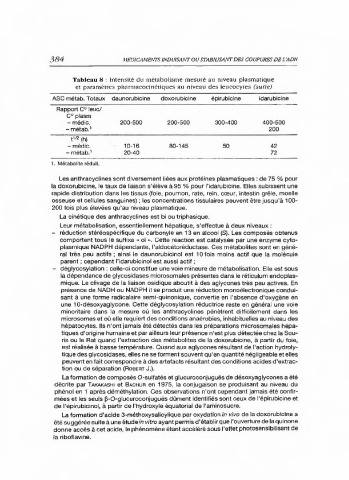
Tableau 8 : Intensité du métabolisme mesuré au niveau plasmatique
et paramètres pharmacocinétiques au niveau des leucocytes (suite)
ASC métab. Totaux daunorubicine doxorubicine épirubicine idarubicine
Rapport C leuc/
CO plasm
- médic. 200-500 200-500 300-400 400-500
- métab.' 200
+v? (h)
- médic. 10-16 80-145 50 42
- métab.' 20-40 72
1. Métabolite réduit.
Les anthracyclines sont diversement liées aux protéines plasmatiques : de 75 % pour
la doxorubicine, le taux de liaison s'élève à 95 % pour l'idarubicine. Elles subissent une
rapide distribution dans les tissus (foie, poumon, rate, rein, ceur, intestin grêle, moelle
osseuse et cellules sanguines) ; les concentrations tissulaires peuvent être jusqu'à 100-
200 fois plus élevées qu'au niveau plasmatique.
La cinétique des anthracyclines est bi ou triphasique.
Leur métabolisation, essentiellement hépatique, s'effectue à deux niveaux :
réduction stéréospécifique du carbonyle en 13 en alcool (S). Les composés obtenus
comportent tous le suffixe « ol ». Cette réaction est catalysée par une enzyme cyto-
plasmique NADPH dépendante, l'aldocétoréductase. Ces métabolites sont en géné-
ral très peu actifs ; ainsi le daunorubicinol est 10 fois moins actif que la molécule
parent ; cependant l'idarubicinol est aussi actif ;
déglycosylation : celle-ci constitue une voie mineure de métabolisation. Elle est sous
la dépendance de glycosidases microsomales présentes dans le réticulum endoplas-
mique. Le clivage de la liaison osidique aboutit à des aglycones très peu actives. En
présence de NADH ou NADPH il se produit une réduction monoélectronique condui-
sant à une forme radicalaire semi-quinonique, convertie en l'absence d'oxygène en
une 10-désoxyaglycone. Cette déglycosylation réductrice reste en général une voie
minoritaire dans la mesure où les anthracyclines pénètrent difficilement dans les
microsomes et où elle requiert des conditions anaérobies, inhabituelles au niveau des
hépatocytes. Ils n'ont jamais été détectés dans les préparations microsomales hépa-
tiques d'origine humaine et par ailleurs leur présence n'est plus détectée chez la Sou-
ris ou le Rat quand l'extraction des métabolites de la doxorubicine, à partir du foie,
est réalisée à basse température. Quand aux aglycones résultant de l'action hydroly-
tique des glycosidases, elles ne se forment souvent qu'en quantité négligeable et elles
peuvent en fait correspondre à des artefacts résultant des conditions acides d'extrac-
tion ou de séparation (ROBERT J.).
La formation de composés O-sulfatés et glucuroconjugués de désoxyaglycones a été
décrite par TAKAKASHI et BACHUR en 1975, la conjugaison se produisant au niveau du
phénol en 1 après déméthylation. Ces observations n'ont cependant jamais été confir-
mées et les seuls 13-0-glucuroconjugués dûment identifiés sont ceux de l'épirubicine et
de l'épirubicinol, à partir de l'hydroxyle équatorial de l'aminosucre.
La formation d'acide 3-méthoxysalicylique par oxydation ln vivo de la doxorubicine a
été suggérée suite à une étude in vitro ayant permis d'établirque l'ouverture de la quinone
donne accès à cet acide, le phénomène étant accéléré sous l'effet photosensibilisant de
la riboflavine.