Page 437 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 437
16 ANTHRACYCLINES UTILISEESEN THERAPEUTIQUE 393
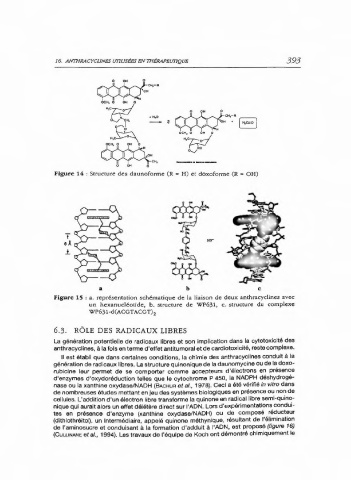
Figure 14 : Structure des daunoforme (R • H) et doxoforme (R- OH)
T
el
±
a b C
Figure 15 : a. représentation schématique de la liaison de deux anthracyclines avec
un hexanucléotide, b. structure de WP631, c. structure du complexe
WP631-dACGTACGT),
6.3. ROLE DES RADICAUX LIBRES
la génération potentielle de radicaux libres et son implication dans la cytotoxicité des
anthracyclines, à la fols en terme d'effet antitumoral et de cardiotoxicité, reste complexe.
11 est établi que dans certaines conditions, fa chimie des anthracycllnes conduit à la
génération de radicaux libres. lastructure quinonique de la daunomycine ou de la doxo-
rubicine leur permet de se comporter comme accepteurs d'électrons en présence
d'enzymes d'oxydoréduction telles que le cytochrome P 450, la NADPH déshydrogé-
nase ou la xanthine oxydase/NADH (BACHuR et al., 1978). Ceci a été vérifié in vitro dans
de nombreuses études mettant en Jeu des systèmes biologiques en présence ou non de
cellules. L'addition d'un électron libre transforme fa quinone en radical libre semi-quino-
nlque qui aurait alors un effet délétère direct sur l'ADN. Lors d'expérimentations condui-
tes en présence d'enzyme (xanthine oxydase/NADH) ou de composé réducteur
(dithiothréitol), un Intermédiaire, appelé quinone méthynique, résultant de l'élimination
de l'aminosucre et conduisant à la formation d'adduit à l'ADN, est proposé (figure 16)
(CuLLINANE et al., 1994). Les travaux de l'équipe de Koch ont démontré chimiquement le