Page 207 - Traité de Chimie Thérapeutique 2 : Médicaments Antibiotiques
P. 207
4. I.ES THIÉNAMYCINES 197
C lofuéne
+ NaH
0
c: COOE NBS 0
Il
0 c ooe
Br
0
".eoo
H
COOH
Br
(+,z) G)
H
t- Cystéine \ C ·Ch.-SH
ooe NH,
CILASTINE
NH, ,Na
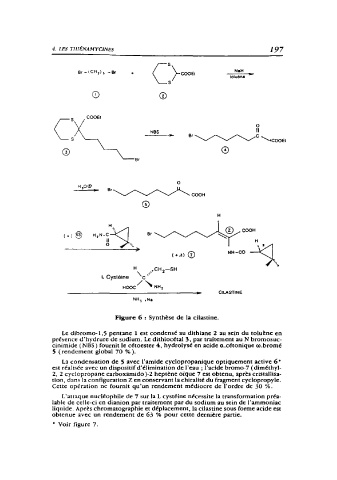
Figure 6 : Synthèse de la cilastine.
Le dibromo-1,5 pentane 1 est condensé au dithiane 2 au sein du toluène en
présence d'hydrure de sodium. Le dithiocétal 3, par traitement au N bromosuc-
cinimide ( NBS) fournit le cétoester 4, hydrolysé en acide a.cétonique o.bromé
5(rendement global 70 % ).
La condensation de S avec l'amide cyclopropanique optiquement active 6
est réalisée avec un dispositif d'élimination de l'eau ; l'acide bromo-7 ( diméthyl-
2, 2 cyclopropane carboxamido )-2 heptène oique 7 est obtenu, après cristallisa-
tion, dans la configuration Zen conservant la chiralité du fragment cyclopropyle.
Cette opération ne fournit qu'un rendement médiocre de l'ordre de 30 %.
L'attaque nucléophile de 7 sur la L cystéine nécessite la transformation préa-
lablc de celle-ci en dianion par traitement par du sodium au sein de l'ammoniac
liquide. Après chromatographie et déplacement, la cilastine sous forme acide est
obtenue avec un rendement de 63 % pour cette dernière partie.
• Voir figure 7.