Page 42 - Traité de Chimie Thérapeutique 2 : Médicaments Antibiotiques
P. 42
32 MÉDICAMENTS ANTIBIOTIQUES
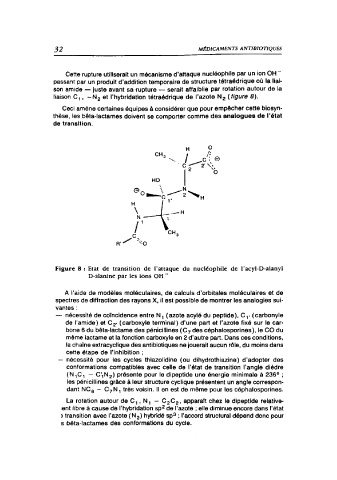
Cette rupture utiliserait un mécanisme d'attaque nucléophile par un ion OH
passant par un produit d'addition temporaire de structure tétraédrique où la liai-
son amide - juste avant sa rupture - serait affaiblie par rotation autour de la
liaison C,, -N, et l'hybridation tétraédrique de l'azote N, (figure 8).
Ceci amène certaines équipes à considérer que pour empêcher cette biosyn-
thèse, les bêta-lactames doivent se comporter comme des analogues de l'état
de transition.
H 0
I /( e
c 2 ,.
HO_ 1 0
.±
•
I' a,
c,
• so
Figure 8 : Etat de transition de l'attaque du nucléophile de l'acy-D-alany
D-alanine par les ions OH
A l'aide de modèles moléculaires, de calculs d'orbitales moléculaires et de
spectres de diffraction des rayons X, il est possible de montrer les analogies sui-
vantes:
nécessité de coïncidence entre N, (azote acyl du peptide), C, ( carbonyle
de l'amide) et C· (carboxyle terminal) d'une part et l'azote fixé sur le car-
bone 6 du bêta-lactame des pénicillines (C, des céphalosporines), le CO du
même iactame et la fonction carboxyle en 2 d'autre part. Dans ces conditions,
la chaine extracyclique des antibiotiques ne jouerait aucun rôle, du moins dans
cette étape de l'inhibition ;
nécessité pour les cycles thiazolidine ( ou dihydrothiazine) d'adopter des
conformations compatibles avec celle de l'état de transition l'angle dièdre
(MC,- C'N,) présente pour le dipeptide une énergie minimale à 236° ;
les pénicillines grâce à leur structure cyclique présentent un angle correspon-
dant NC - C,N, très voisin. Il en est de même pour les céphalosporines.
La rotation autour de C,,N,-C C , apparaît chez le dipeptide relative-
2
2
2
ent libre à cause de l'hybridation sp de l'azote; elle diminue encore dans l'état
3
3 transition avec l'azote (N ) hybridé sp ; l'accord structural dépend donc pour
2
s bêta-lactames des conformations du cycle.