Page 129 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 129
Partie 1 ■ Chimie organique générale
Exemple
La réaction CH Br+OH- ➔ CH 0H+Br- a lieu dans une collision entre une molécule de bromométhane
3 3
CH,Br et un ion hydroxyle OH. Elle comporte la rupture d'une liaison C Br et la formation d'une liaison
CO,et l'état de transition peut, approximativement, se représenter par [Br---CH,---OH] : les deux réac-
tifs ne « font plus qu'un» dans un complexe où la liaison C Br est «en train de se rompre» en même
temps que la liaison C Oest «en train de se former». Ce complexe finira par se scinder en CH,OH et Br .
'auesion 5.s
Par quel mécanisme une flamme « allume »-t-elle une combustion? Comment se fait-il que l'on puisse
enflammer une matière combustible sans l'aide d'une flamme (par exemple, en concentrant les
rayons du soleil avec une loupe)?
Pourquoi ne peut-on pas faire brûler du bois humide?
Essayez de donner à chacune de ces questions une réponse« scientifique».
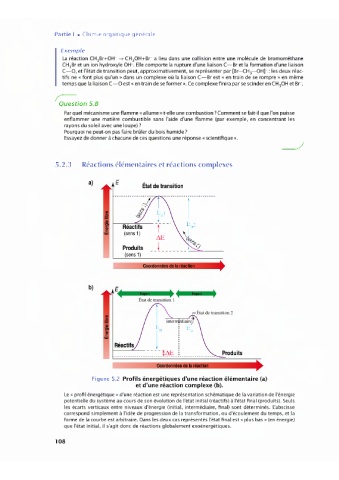
5.2.3 Réactions élémentaires et réactions complexes
a)
• État de transition
-- l
l f
a,
C
w -
AE
Produits _J _______
(sens 1)
Coordonnées da la
b)
•
~
État de transition 1
Coordonnées da la nia
Figure 5.2 Profils énergétiques d'une réaction élémentaire (a)
et d'une réaction complexe (b).
Le «profil énergétique» d'une réaction est une représentation schématique de la variation de l'énergie
potentielle du système au cours de son évolution de l'état initial (réactifs) à l'état final (produits). Seuls
les écarts verticaux entre niveaux d'énergie (initial, intermédiaire, final) sont déterminés. L'abscisse
correspond simplement à l'idée de progression de la transformation, ou d'écoulement du temps, et la
forme de la courbe est arbitraire. Dans les deux cas représentés l'état final est « plus bas» (en énergie)
que l'état initial, il s'agit donc de réactions globalement exoénergétiques.
108