Page 295 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 295
Partie Il ■ Chimie organique descriptive
p • La première étape de la réaction (formation de l'intermédiaire cationique) est cinétiquement déter-
minante. La vitesse globale de la réaction est déterminée par la vitesse propre de cette étape qui
page 109
p dépend de son énergie d'activation (El sur la figure 12.1) laquelle est liée à la stabilité de l'intermé-
diaire. Or les trois orientations ortho, méta et para correspondent à des intermédiaires différents, de
chap. 5, stabilités différentes, et la réaction passe préférentiellement par le (ou les) plus stable(s).
§ 5.2.3
Il faut donc examiner, pour chaque type de substituant, quelle influence il a pu avoir sur ces deux
points.
'aesin 12.F
Quelle autre «règle » a été précédemment interprétée sur des bases analogues?
Substitutions en présence d'un groupe ortho/para-orienteur
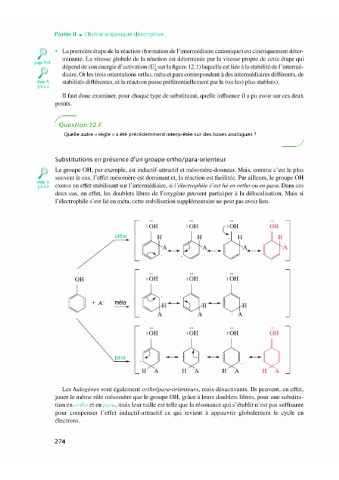
p Le groupe OH, par exemple, est inductif-attractif et mésomère-donneur. Mais, comme c'est le plus
souvent le cas, l'effet mésomère est dominant et, la réaction est facilitée. Par ailleurs, le groupe OH
chap. 4,
§ 4.4.1 exerce un effet stabilisant sur l'intermédiaire, si l'électrophile s'est lié en ortho ou en para. Dans ces
deux cas, en effet, les doublets libres de l'oxygène peuvent participer à la délocalisation. Mais si
l'électrophile s'est lié en méta, cette stabilisation supplémentaire ne peut pas avoir lieu.
·OH ·OH "OH oH
=1#3 • A
ortho
.. .-f
.·
"
.. .. ..
OH : OH : OH : OH
- méta 6 +0 6n
b nl
------
A A + A
: OH : OH : OH OH
.te--t---«
H A H A H A H A
Les halogènes sont également ortho!para-orienteurs, mais désactivants. Ils peuvent, en effet,
jouer le même rôle mésomère que le groupe OH, grâce à leurs doublets libres, pour une substitu-
tion en ortho et en para, mais leur taille est telle que la résonance qui s'établit n'est pas suffisante
pour compenser l'effet inductif-attractif ce qui revient à appauvrir globalement le cycle en
électrons.
274