Page 603 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 603
Partie Il ■ Chimie organique descriptive
donnons un certain nombre d'outils élémentaires de la chimie organique qui ont été utilisés pour une
meilleure compréhension de cette discipline et pour la mise en place des mécanismes réactionnels.
26.3.1 Contrôle cinétique - contrôle thermodynamique
La composition finale des produits d'une réaction peut être gouvernée par leur stabilité relative, on
parle alors dans ce cas de contrôle thermodynamique. Il s'agit notamment des réactions acido-
basiques étudiées dans le chapitre 5 où le résultat de la réaction dépend des valeurs respectives des
pKa des couples mis en jeu. Dans d'autres cas, ce sont les vitesses des réactions compétitives qui
déterminent la composition finale, on parle alors de contrôle cinétique. Il s'agit notamment des
réactions de substitution nucléophile et d'élimination vues au chapitre 13. Certaines réactions,
quant à elles, peuvent être soit sous contrôle cinétique soit sous contrôle thermodynamique. L'ex-
périmentateur pourra alors contrôler la nature des produits formés en modulant les conditions
opératoires telles que la température et le temps de réaction mais également la quantité des réactifs
impliqués.
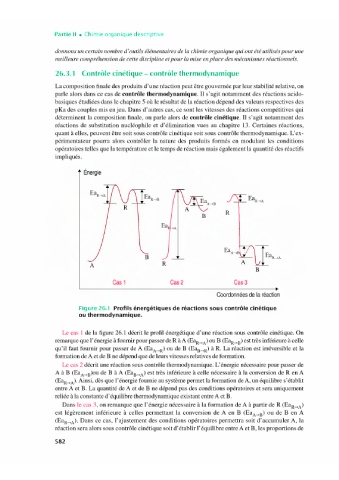
Énergie
R
B
Ea
A
A R
B
Cas 1 Cas2 Cas3
Coordonnées de la réaction
Figure 26.1 Profils énergétiques de réactions sous contrôle cinétique
ou thermodynamique.
Le cas 1 de la figure 26.1 décrit le profil énergétique d'une réaction sous contrôle cinétique. On
remarque que F énergie à fournir pour passer de R à A Ea,,)ou B Ea,_,p)est très inférieure à celle
qu'il faut fournir pour passer de A (Ea,p) ou de B Ea,,.p) à R. La réaction est irréversible et la
formation de A et de B ne dépend que de leurs vitesses relatives de formation.
Le cas 2 décrit une réaction sous contrôle thermodynamique. L'énergie nécessaire pour passer de
A à BEa,,p)ou de B à A Ea,,) est très inférieure à celle nécessaire à la conversion de R en A
Ea,,). Ainsi, dès que l'énergie fournie au système permet la formation de A, un équilibre s'établit
entre A et B. La quantité de A et de B ne dépend pas des conditions opératoires et sera uniquement
reliée à la constante d'équilibre thermodynamique existant entre A et B.
Dans le cas 3, on remarque que l'énergie nécessaire à la formation de A à partir de R (Ea,,)
est légèrement inférieure à celles permettant la conversion de A en B (Ea,) ou de B en A
Ea,,_,p). Dans ce cas, F ajustement des conditions opératoires permettra soit d'accumuler A, la
réaction sera alors sous contrôle cinétique soit d'établir l'équilibre entre A et B, les proportions de
582