Page 623 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 623
Partie Il ■ Chimie organique descriptive
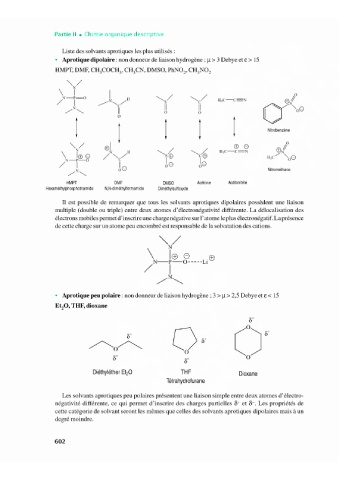
Liste des solvants aprotiques les plus utilisés :
• Aprotique dipolaire: non donneur de liaison hydrogène ; µ > 3 Debye et€> 15
HMPT, DMF, CH,COCH,, CH,CN, DMSO, PINO, CH,NO,
"" /
N
\ 1 0
N-P=0 1 H '-----s/ -------_/ (±) ,f
/ ___.-------N"--- / C HC C .N
1
C Il Il UN'VJ
/ N----.._,___ Il 0 0
0
l l 1 l 1 Nitrobenzène
ol (±) O o. 0
"" / . " H3C-C=N
N
\ loo / '-----c '-----s~ '-----c~ / N
N-P-0 c >O
/ 1 1 lo lo
N' 6O Nitrométhane
HMPT DMF DMSO Acétone Acétonitrile
Hexaméthylphosphotriamide N,N-diméthylformamide Diméthylsulfoxyde
Il est possible de remarquer que tous les solvants aprotiques dipolaires possèdent une liaison
multiple (double ou triple) entre deux atomes d' électronégativité différente. La délocalisation des
électrons mobiles permet d'inscrire une charge négative sur l'atome le plus électronégatif. La présence
de cette charge sur un atome peu encombré est responsable de la solvatation des cations.
"" /
N
\ 1(±) 8 (±)
N-P-O-----Li
/ 1
"
• Aprotique peu polaire: non donneur de liaison hydrogène; 3 > µ > 2,5 Debye et€< 15
Et,O, THE, dioxane
6
0
•
6 ()0'
~o~ 0
6 6 0
Diéthyléther Et,O THF Dioxane
Tétrahydrofurane
Les solvants aprotiques peu polaires présentent une liaison simple entre deux atomes d' électro-
négativité différente, ce qui permet d'inscrire des charges partielles 8+ et ◊-. Les propriétés de
cette catégorie de solvant seront les mêmes que celles des solvants aprotiques dipolaires mais à un
degré moindre.
602