Page 160 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 160
2. MÉDICAMENTS DU DIABÈTE SUCRÉ UTILISABLES PAR VOLE ORALE 121
2.2.1.3. INHIBITEURS IRRÉVERSIBLES
A partir du modèle de l'alrestatine, des tentatives ont été réalisées pour augmenter
l'efficacité anti-enzymatique par la réalisation d'inhibiteurs irréversibles. Ceci a
d'abord été obtenu en introduisant en 5 un reste isothiocyanate : N=C=S ou azide : N3
(figure 14). Ces deux substitutions procurent à 10-4 mol/l une inhibition à 70 % durant
une minute.
Plus récemment, c'est l'introduction en 5, sur le noyau benzofd, ejisoquindéine de
l'alrestatine, d'un reste bromo ou iodoacétamido qui fournit cette inhibition irréver
sible. Par contre, l'analogue chloroacétamido est inactif.
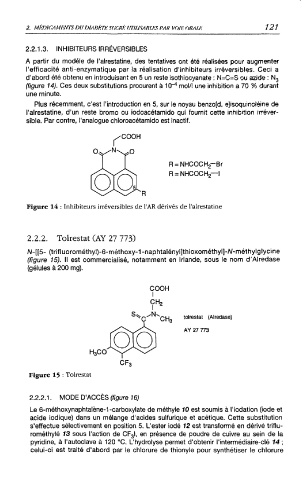
R = NHCOCH2- Br
R = NHCOCH2—I
Figure 14 : Inhibiteurs irréversibles de l'AR dérivés de l'alrestatine
2.2.2. Tolrestat (AY 27 773)
A/-[[5- (trifluorométhyl)-6-méthoxy-1-naphtalényl]thioxométhyl]-/V-méthylglycine
(figure 15). Il est commercialisé, notamment en Irlande, sous le nom d'Alredase
(gélules à 200 mg).
tolrestat (Alredase)
AY 27 773
Figure 15 : Tolrestat
2.2.2.1. MODE D'ACCÈS (figure 16)
Le 6-méthoxynaphtalène-1 -carboxylate de méthyle 10 est soumis à l'iodation (iode et
acide iodique) dans un mélange d'acides sulfurique et acétique. Cette substitution
s'effectue sélectivement en position 5. L'ester iodé 12 est transformé en dérivé triflu-
rométhylé 13 sous l'action de CF3I, en présence de poudre de cuivre au sein de la
pyridine, à l'autoclave à 120 °C. L'hydrolyse permet d'obtenir l'intermédiaire-clé 14 ;
celui-ci est traité d'abord par le chlorure de thionyle pour synthétiser le chlorure