Page 309 - Traité de Chimie Thérapeutique 4 Médicaments en relation avec des systèmes hormonaux
P. 309
270 MÉDICAMENTS EN RELA TION Al'EC DES SYSTÈMES HORMONA UX
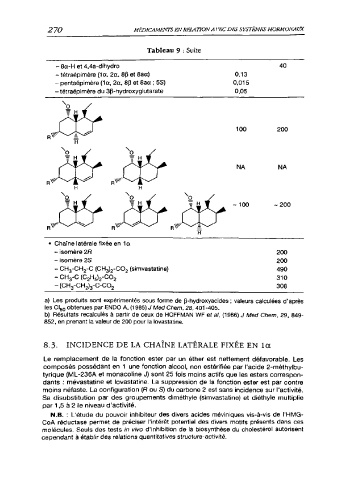
Tableau 9 : Suite
- 8a-H et 4,4a-dihydro 40
- tétraépimère (1 a, 2a, 8P et 8aa) 0,13
- pentaépimère (1 a, 2a, 8p et 8aa ; 5S) 0,015
- tétraépimère du 3P-hydroxyglutarate 0,05
100 200
NA NA
~ 100 - 200
• Chaîne latérale fixée en 1a
- isomère 2R 200
- isomère 2S 200
- CH3-CH2-C (CH^-CC^ (simvastatine) 490
- CH3-C (C2H5)2-CO2 310
- (CH3-CH2)3-C-CO2 308
a) Les produits sont expérimentés sous forme de p-hydroxyacides ; valeurs calculées d'après
les CI50 obtenues par ENDO A, (1985) J Med Chem, 28, 401 -405.
b) Résultats recalculés à partir de ceux de HOFFMAN WF et al, (1986) J Med Chem, 29, 849-
852, en prenant la valeur de 200 pour la lovastatine.
8.3. INCIDENCE DE LA CHAÎNE LATÉRALE FIXÉE EN la
Le remplacement de la fonction ester par un éther est nettement défavorable. Les
composés possédant en 1 une fonction alcool, non estérifiée par l'acide 2-méthylbu-
tyrique (ML-236A et monacoline J) sont 25 fois moins actifs que les esters correspon
dants : mévastatine et lovastatine. La suppression de la fonction ester est par contre
moins néfaste. La configuration (R ou S) du carbone 2 est sans incidence sur l'activité.
Sa disubstitution par des groupements diméthyle (simvastatine) et diéthyle multiplie
par 1,5 à 2 le niveau d'activité.
N.B. : L'étude du pouvoir inhibiteur des divers acides méviniques vis-à-vis de l'HMG-
CoA réductase permet de préciser l'intérêt potentiel des divers motifs présents dans ces
molécules. Seuls des tests in vivo d'inhibition de la biosynthèse du cholestérol autorisent
cependant à établir des relations quantitatives structure-activité.