Page 247 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 247
JO. DACARBA ZINE ETTEM OZOLOMIDE 203
N
,,:ÇZ CO-NH2
\ /J Me
HN N--N/
', ('\r-CO-Ntti
{] wnc:z ( ·
o Nt,
HN-( N=N_.,..Me AIC: f ciazanéet>ane .24
NH/ '-H
isoMTIC: 27'
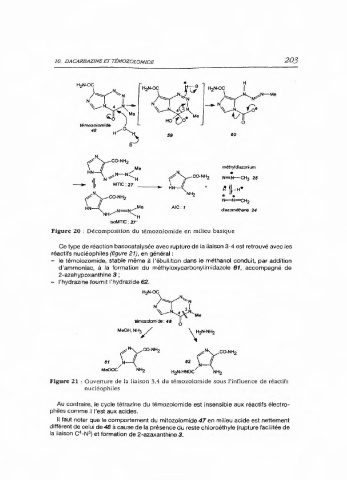
Figure 20 : Décomposition du témozolomide en milieu basique
Ce type de réaction basocatalysée avec rupture de la liaison 3-4 est retrouvé avec les
réactifs nucléophiles (figure 21), en général:
- le témolozomide, stable même à l'ébullition dans le méthanol conduit, par addition
d'ammoniac, à la formation du méthyloxycarbonylimidazole 61, accompagné de
2-azahypoxanthine 3 ;
- l'hydrazine fournit l'hydrazide 62.
",_- {
r
$e.
l!mazolanide : ,a 0
\e
/J
If N /J 82 Q CO-Ntti
Meooc " ttiN-HNOC/ NI½
Nt12
Figure 21 : Ouverture de la liaison 3,4 du témozolomide sous l'influence de réactifs
nucléophiles
Au contraire, le cycle tétrazine du témozolomide est insensible aux réactifs électro-
philes comme il l'est aux acides.
11 faut noter que le comportement du mitozolomide 47 en milieu acide est nettement
différent de celui de 48 à cause de la présence du reste chloroéthyle (rupture facilitée de
la liaison C-N) et formation de 2-azaxanthine 3.