Page 593 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 593
Partie Il ■ Chimie organique descriptive
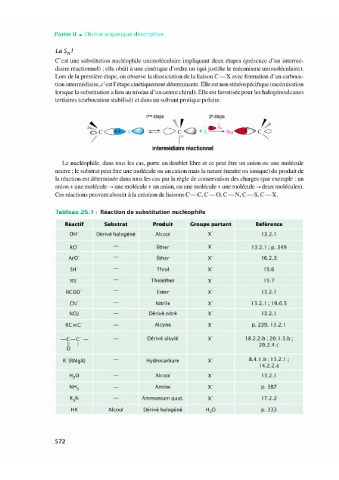
La SI
C'est une substitution nucléophile unimoléculaire impliquant deux étapes (présence d'un intermé-
diaire réactionnel) ; elle obéit à une cinétique d'ordre un (qui justifie le mécanisme unimoléculaire).
Lors de la première étape, on observe la dissociation de la liaison C-X avec formation d'un carboca-
tion intermédiaire, c'est l'étape cinétiquement déterminante. Elle est non stéréospécifique (racémisation
lorsque la substitution a lieu au niveau d'un centre chiral). Elle est favorisée pour les halogénoalcanes
tertiaires (carbocation stabilisé) et dans un solvant protique polaire.
1ère étape 2• étape
« z 7.
N , > ..@,g,
C> C<D X: C) +x Nuet?CO
7
intermédiaire réactionnel
Le nucléophile, dans tous les cas, porte un doublet libre et ce peut être un anion ou une molécule
neutre; le substrat peut être une molécule ou un cation mais la nature (neutre ou ionique) du produit de
la réaction est déterminée dans tous les cas par la règle de conservation des charges (par exemple : un
anion+ une molécule--+ une molécule+ un anion, ou une molécule+ une molécule» deux molécules).
Ces réactions peuvent aboutir à la création de liaisons C-C, C-O, C-N, C-S, C-X.
Tableau 26.1: Réaction de substitution nucléophile
Réactif Substrat Produit Groupe partant Référence
OH Dérivé halogéné Alcool X 13.2. l
RO Éther X 13.2. l ; p. 349
ArO Éther X 16.2.3
SH Thiol X 15.6
RS Thioéther X 15.7
RCOO Ester X 13.2. l
CN Nitrile X 13.2.1;19.6.5
NOz Dérivé nitré X 13.2. l
RC=C Alcyne X p. 239, 13.2. l
CC Dérivé alkylé X 18.2.2.b; 20.1.3.b;
Il 1 20.2.4.c
0
R (RMgX) Hydrocarbure X 8.4. l.b; 13.2. l ;
14.2.2.a
H,O Alcool X 13.2. l
NH, Amine X p.387
R,N Ammonium quat. X 17.2.2
HX Alcool Dérivé halogéné H,O p.333
572