Page 668 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 668
21.d (b)Q (c)Q (d)Q
1) (a)
S/ Br S MgBr S C0 2 H
2)(e)
21.e 1) Le tétrahydrofurane se comporte comme 3) Ouverture du cycle par hydrolyse, comme un
un éther et subit une coupure acide [p. 349]. - époxyde [question 9.F] ; il se forme un double
2) La pyridine joue le rôle de la base dans une énol qui se réarrange en dicétone.
élimination [cf. 13.2.2].
Chapitre 22
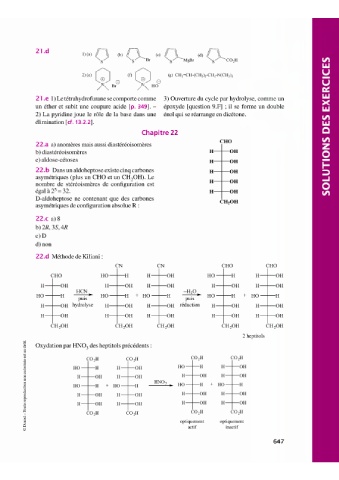
CHO
22.a a) anomères mais aussi diastéréoisomères
b) diastéréoisomères H OH
c) aldose-cétoses H OH
22. b Dans un aldoheptose existe cinq carbones H OH
asymétriques (plus un CHO et un CH,OH). Le
H OH
nombre de stéréoismères de configuration est
égal a 2°= 32. H OH
D-aldoheptose ne contenant que des carbones
CH,OH
asymétriques de configuration absolue R :
22.c a) 8
b)2R, 3S,4R
c)D
d)non
22.d Méthode de Kiliani:
CN CN CHO CHO
CHO HO H H OH HO H H OH
- -H-O
H OH H OH H OH H OH H OH
HCN
HO H puis HO H + HO H puis HO H + HO H
H OH hydrolyse H OH H OH réduction H OH H OH
H OH H OH H OH H OH H OH
CH,OH CH,OH CH,OH CH,OH CH,OH
2 heptitols
~
"d Oxydation par HNO, des heptitols précédents :
~
3
îî CO,H CO-3H
t) CO,H CO-3H
)
-~ HO H H OH HO H H OH
z
: H OH H OH H OH H OH
0
:
: HNO,
·.g 0 HO H + HO H HO H + HO H
3
"d H OH H OH
0 H OH H OH
±
t) H OH H OH H OH H OH
s
F CO,H CO,H CO-3H
1 CO-3H
"d
0
: optiquement optiquement
~ 3 actif inactif
g
647